
【题目】工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):
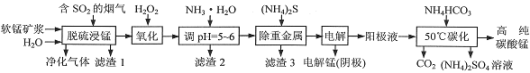
(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为__。
(2)“滤渣2”中主要成分的化学式为__。
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是__。
(4)“电解”时用惰性电极,阳极的电极反应式为__。
(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为___。“50℃碳化”时加入过量NH4HCO3,可能的原因是__(写两种)。
(6)已知:25℃时,Kw=1.0×10-14,Ka(NH3·H2O)=1.75×10-5。在(NH4)2SO4溶液中,存在如下平衡:NH4++H2O![]() NH3·H2O+H+,则该反应的平衡常数为__。
NH3·H2O+H+,则该反应的平衡常数为__。
【答案】MnO2+SO2=MnSO4或H2O+SO2 =H2SO3、MnO2+H2SO3=MnSO4+H2O Fe(OH)3、Al(OH)3 会导致生成物(NH4)2SO4中出现杂质 4OH--4e-=O2↑+2H2O Mn2++2HCO3-![]() MnCO3↓+CO2↑+H2O 使MnSO4充分转化为MnCO3;NH4HCO3受热易分解,造成损失;NH4HCO3能与H+反应,防止MnCO3沉淀溶解损失 5.7×10-10
MnCO3↓+CO2↑+H2O 使MnSO4充分转化为MnCO3;NH4HCO3受热易分解,造成损失;NH4HCO3能与H+反应,防止MnCO3沉淀溶解损失 5.7×10-10
【解析】
由流程可知,“脱硫浸锰”环节,二氧化硫与软锰矿浆作用生成硫酸锰和少量的硫酸铝、硫酸亚铁等,二氧化硅不反应经过滤成为滤渣Ⅰ,氧化环节,双氧水可将亚铁离子氧化为铁离子,加氨水调节溶液的PH为5—6把铁离子和铝离子转化为沉淀除去,加硫化铵把重金属离子转化为沉淀除去,通过电解得到金属锰;在阳极液中加碳酸氢铵得碳酸锰和硫酸铵。
(1)“脱硫浸锰”环节,二氧化硫与二氧化锰发生氧化还原反应生成MnSO4,反应的化学方程式为 MnO2+SO2=MnSO4或H2O+SO2=H2SO3、MnO2+H2SO3=MnSO4+H2O;
(2)根据流程图,加入氨水沉淀铁离子、铝离子等金属阳离子,“滤渣2”主要成分的化学式为Fe(OH)3、Al(OH)3;
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是加Na2S会引入钠离子,会导致生成物(NH4)2SO4中出现杂质Na2SO4;
(4)“电解”时用惰性电极,阳极应该是水电离出的氢氧根离子放电,电极反应式为 2H2O-4e-=O2↑+4H+或4OH--4e-=O2↑+2H2O;
(5)“50 ℃碳化”得到高纯碳酸锰,反应的离子方程式为 Mn2++2HCO3-![]() MnCO3↓+CO2↑+H2O;原溶液显酸性,且碳酸氢铵受热易分解,故“50 ℃碳化”时加入过量NH4HCO3,可能的原因是NH4HCO3与H+反应,防止MnCO3沉淀溶解损失,以及防止NH4HCO3受热分解损失,还可以使MnSO4充分转化为MnCO3;
MnCO3↓+CO2↑+H2O;原溶液显酸性,且碳酸氢铵受热易分解,故“50 ℃碳化”时加入过量NH4HCO3,可能的原因是NH4HCO3与H+反应,防止MnCO3沉淀溶解损失,以及防止NH4HCO3受热分解损失,还可以使MnSO4充分转化为MnCO3;
(6)根据方程式NH4++H2O![]() NH3·H2O+H+可知反应的平衡常数=
NH3·H2O+H+可知反应的平衡常数=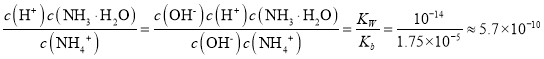 。
。


科目:高中化学 来源: 题型:
【题目】已知,常温下CH3COOH和NH3·H2O的电离常数均为1.8×10-5。某小组进行如图三组实验且实验II、III中Mg(OH)2固体均溶解。下列说法正确的是

A.I中现象说明NH3·H2O碱性强于Mg(OH)2
B.II中总反应为2H++Mg(OH)2=Mg2++2H2O
C.实验II、III研究NH4+对Mg(OH)2溶解的作用原理
D.III中CH3COONH4浓度越小,越有利于沉淀的溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法不正确的是
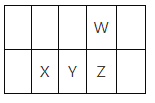
A.原子半径:W<XB.常温常压下,Y单质为固态
C.最高价氧化物对应水化物的酸性:Y<ZD.X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年国际非政府组织“全球碳计划”12月4日发布报告:研究显示,全球二氧化碳排放量增速趋缓。CO2的综合利用是解决温室问题的有效途径。
(1)一种途径是将CO2转化成有机物实现碳循环。如:
C2H4(g)+H2O(l)=C2H5OH(l) ΔH1=-44.2kJ·mol-1
2CO2(g)+2H2O(l)=C2H4(g)+3O2(g) ΔH2=+1411.0kJ·mol-1
2CO2(g)+3H2O(l)=C2H5OH(l)+3O2(g) ΔH3=___。
(2)CO2甲烷化反应是由法国化学家Sabatier提出的,因此,该反应又叫Sabatier反应。CO2催化氢化制甲烷的研究过程如图:
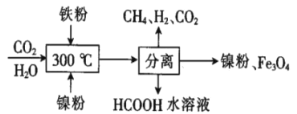
上述过程中,产生H2反应的化学方程式为__。
②HCOOH是CO2转化为CH4的中间体:CO2![]() HCOOH
HCOOH![]() CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是__(填“I”或“Ⅱ”)。
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是__(填“I”或“Ⅱ”)。
(3)CO2经催化加氢可以生成低碳烃,主要有两个竞争反应:
反应I:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
反应Ⅱ:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
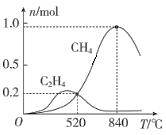
在1L恒容密闭容器中充入1molCO2和4molH2,测得平衡时有关物质的物质的量随温度变化如图所示。520℃时,CO2的转化率为__,520℃时,反应I的平衡常数K=__。
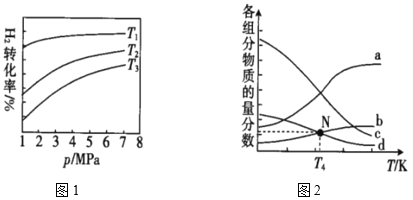
(4)已知CO2催化加氢合成乙醇的反应原理为2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) ΔH。m代表起始时的投料比,即m=
C2H5OH(g)+3H2O(g) ΔH。m代表起始时的投料比,即m=![]() 。图1中投料比相同,温度T3>T2>T1,则ΔH___(填“>”或“<”)0。
。图1中投料比相同,温度T3>T2>T1,则ΔH___(填“>”或“<”)0。
②m=3时,该反应达到平衡状态后p(总)=20Mpa,恒压条件下各物质的物质的量分数与温度的关系如图2。则曲线b代表的物质为___(填化学式),T4温度时,反应达到平衡时物质d的分压p(d)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】佛罗那可用于治疗新生儿高胆红素血症。以甲苯为原料制备佛罗那的合成路线如图:
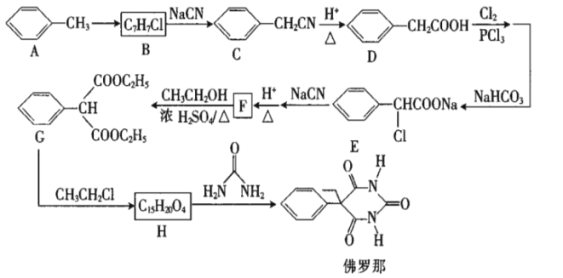
回答下列问题:
(1)D的名称是__,B中官能团的名称为__。
(2)写出H的结构简式:__。
(3)结构中不含碳碳双键,有六个碳原子在同一条直线上的B的同分异构体的结构简式有__种(不考虑立体异构),写出其中一种结构的结构简式:__。
(4)上述合成路线中有字母代号的物质中有手性碳原子的是__(填字母代号)。(已知:连有四个不同的原子或原子团的碳原子称为手性碳原子)
(5)H→佛罗那的反应类型为__。
(6)写出F→G的化学方程式:__。
(7)参照上述合成路线,设计以丙二酸、乙醇和氯乙烷为原料合成乙基丙二酸的合成路线__(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:
(1)氮原子价层电子对的轨道表达式(电子排布图)为_____________。
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________;氮元素的E1呈现异常的原因是__________。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
A.中心原子的杂化轨道类型 B.中心原子的价层电子对数
C.立体结构 D.共价键类型
②R中阴离子N5-中的σ键总数为________个。分子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则N5-中的大π键应表示为____________。
),则N5-中的大π键应表示为____________。
③图(b)中虚线代表氢键,其表示式为(NH4+)N-H┄Cl、____________、____________。

(4)R的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y的计算表达式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.电离平衡常数是衡量弱电解质电离程度的量,已知如表数据(25℃):
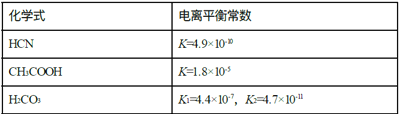
(1)25℃时,下列物质的量浓度相同的四种溶液的pH由大到小的顺序为_____(填序号)
a NaCN溶液 b Na2CO3溶液 c CH3COONa溶液 d NaHCO3溶液
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为____________。
Ⅱ.根据下列化合物:①NaOH ②H2SO4 ③CH3COOH ④NaCl ⑤CH3COONa ⑥(NH4)2SO4 ⑦CH3COONH4 ⑧NH4HSO4 ⑨NH3H2O ⑩NH4Cl,请回答下列问题:
(1)常温下,若pH均为11且等体积的NaOH和NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则m_______n(填“<”、“>”或“=”)。
(2)已知水存在如下平衡:H2O![]() H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是____________。
H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是____________。
A 向水中加入NaHSO4固体 B 向水中加NaHCO3固体
C 加热至100℃[其中c(H+)=1×10-6 mol·L-1] D 向水中加入NH4Cl固体
(3)物质的量浓度相同的①、②、③、④、⑤、⑥六种稀溶液中,水电离的OH-浓度由大到小的顺序为(填序号)__________。
(4)物质的量浓度相同的⑥、⑦、⑧、⑨、⑩五种稀溶液中,NH4+浓度由大到小的顺序是(填序号)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.向显蓝色的淀粉溶液中通入足量![]() 后变成无色溶液:
后变成无色溶液:![]()
B.电离平衡常数:![]() ,向
,向![]() 溶液中通入少量
溶液中通入少量![]() :
:![]()
C.![]() 溶液与过量
溶液与过量![]() 溶液反应:
溶液反应:![]()
D.![]() 溶液中通入过量
溶液中通入过量![]() :
:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是生命的源泉、工业的血液、城市的命脉。河水01是主要的饮用水源,污染物通过饮用水可宵接毒害人体,也可通过食物链和溉溉农田间接危及健康。请回答下列问题:
(1)纯水在100℃时,pH=6,该温度下1molL-1的NaOH溶液中,由水电离出的c(OH-)=___molL-1。
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为___。
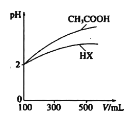
(3)体积均为100mLpH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则相同温度时,HX的电离平衡常数___(填“大于”或“小于”或“等丁”)CH3COOH的电离平衡常数,理由是___。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
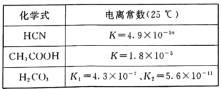
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三种溶液的pH由大到小的顺序为____。
②向NaCN溶液中通人少量的C02,发生反应的化学方程式为___。
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH = 6,则溶液中c(CH3COO-)-c(Na+)=___molL-1(填精确值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com