
【题目】下列离子方程式书写正确的是( )
A.向显蓝色的淀粉溶液中通入足量![]() 后变成无色溶液:
后变成无色溶液:![]()
B.电离平衡常数:![]() ,向
,向![]() 溶液中通入少量
溶液中通入少量![]() :
:![]()
C.![]() 溶液与过量
溶液与过量![]() 溶液反应:
溶液反应:![]()
D.![]() 溶液中通入过量
溶液中通入过量![]() :
:![]()
【答案】A
【解析】
A.显蓝色的淀粉溶液中通入足量SO2后变成无色溶液,是因为碘氧化了SO2,其离子反应方程式为:I2+SO2 +2H2O =2I- +SO42- +4H+,故A正确;
B.向NaClO溶液中通入少量二氧化碳发生了强酸制弱酸的反应,其离子反应方程式为:ClO- +CO2+H2O= HClO+HCO3-,故B错误;
C. NH4HCO3溶液与过量NaOH溶液反应的离子反应为:HCO3-+NH4++2OH- =NH3↑+2H2O+CO32-,故C错误;
D. FeI2溶液中通入过量Cl2的离子反应为:2Fe2++4I- +3Cl2=2Fe3+ +2I2 +6Cl-,故D错误;
故选A。


科目:高中化学 来源: 题型:
【题目】现有几组物质的熔点(℃)的数据:
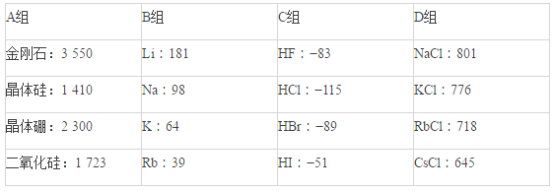
据此回答下列问题:
(1)A组属于___________晶体,其熔化时克服的微粒间的作用力是__________________。
(2)B组晶体共同的物理性质是___________________(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于_______________________________________。
(4)D组晶体可能具有的性质是_________________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因解释为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):
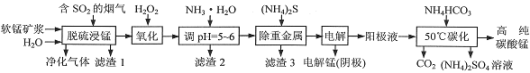
(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为__。
(2)“滤渣2”中主要成分的化学式为__。
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是__。
(4)“电解”时用惰性电极,阳极的电极反应式为__。
(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为___。“50℃碳化”时加入过量NH4HCO3,可能的原因是__(写两种)。
(6)已知:25℃时,Kw=1.0×10-14,Ka(NH3·H2O)=1.75×10-5。在(NH4)2SO4溶液中,存在如下平衡:NH4++H2O![]() NH3·H2O+H+,则该反应的平衡常数为__。
NH3·H2O+H+,则该反应的平衡常数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素是一种重要的非金属元素,可形成多种化合物。试回答下列有关问题:
(1)①已知4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1对于该反应,改变某一反应条件,(已知温度T2>T1)下列图像正确的是_______(填代号)
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1对于该反应,改变某一反应条件,(已知温度T2>T1)下列图像正确的是_______(填代号)

②已知CO与H2O在一定条件下可以发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH= - Q kJ·mol-1 ,820 ℃时在甲、乙两个恒容密闭容器中,起始时按照下表进行投料,经过一段时间后达到平衡状态,若甲中CO的转化率为40%,则该反应的平衡常数为____________;乙容器吸收的热量为________________。
CO2(g)+H2(g) ΔH= - Q kJ·mol-1 ,820 ℃时在甲、乙两个恒容密闭容器中,起始时按照下表进行投料,经过一段时间后达到平衡状态,若甲中CO的转化率为40%,则该反应的平衡常数为____________;乙容器吸收的热量为________________。
![]()
(2)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气,已知:
① N2 (g) +2O2 (g) = N2O4 (l) ΔH =-19.5 kJ·mol-1
② N2H4(l)+O2(g) = N2(g) +2H2O(g) ΔH =-534.2 kJ·mol-1
写出肼与四氧化二氮反应的热化学方式______________。
(3)纯的叠氮酸(HN3)是无色液体,常用做引爆剂,常温下向25 mL 0.1mol·L-1 NaOH溶液中加入0. 2mol·L-1 HN3的溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如图。

①根据图像写出HN3的电离方程式:_________。
②下列说法正确的是_________________(填序号)
A.若用已知浓度的NaOH溶液滴定HN3溶液来测定HN3的浓度时应用甲基橙作指示剂
B.常温下,向0.2 mol·L-1 HN3的溶液中加水稀释,则![]() 不变
不变
C.分别中和pH均为4的HN3溶液和HCl溶液,消耗0.1 mol·L-1 NaOH溶液的体积相同
D.D点时溶液中离子浓度存在如下关系:2c(H+) + c(HN3) =c(N3-) + 2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置,在仪器①②③中分别依次加入下列各选项中所对应的试剂进行实验,能达到实验目的的是

A. 浓盐酸、浓硫酸、浓硫酸,制取干燥的氯化氢气体
B. 浓盐酸、二氧化锰、饱和食盐水,制取纯浄的氯气
C. 稀硫酸、溶液X、澄清石灰水,检验溶液X中是否含有CO32—
D. 浓盐酸、碳酸钙、水玻璃,验证盐酸、碳酸、硅酸的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用浓度相同的氯水、Cl2的CCl4溶液完成下述实验。下列有关实验的说法中,不正确的是
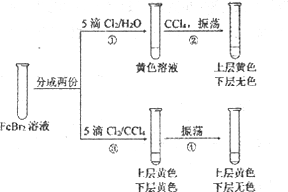
A. 操作④中发生的反应是Br2+ 2Fe2+=2Br-+2Fe3+
B. 操作②和操作④之后,试管上层溶液的成分相同
C. 操作①后的溶液中没有Br2,但反应过程中可能有Br2生成
D. 实验说明,CCl4影响了Cl2、Br2和Fe3+氧化性的强弱顺序
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得结论正确的是
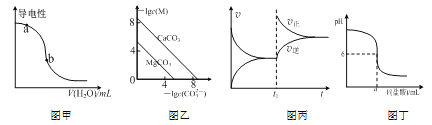
A.图甲表示一定温度下,CH3COOH稀溶液加水时溶液的导电性变化,则pH(a)>pH(b)
B.图乙表示一定温度下,MCO3(M:Mg2+、Ca2+)的沉淀溶解平衡曲线,则Ksp(MgCO3)<Ksp(CaCO3)
C.图丙表示一定温度下,可逆反应N2(g)+3H2(g) ![]() 2NH3(g)正逆反应速率随时间变化的曲线,t1时改变的条件可能是分离出NH3
2NH3(g)正逆反应速率随时间变化的曲线,t1时改变的条件可能是分离出NH3
D.图丁表示常温下将0.1 mol·L-1盐酸溶液滴加到a mL0.1 mol·L-1BOH溶液中,所得溶液pH随所加入盐酸溶液体积的变化图,则BOH为弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸是二元弱酸,0.2 mol·L-1NaHC2O4溶液显酸性,关于NaHC2O4溶液中离子浓度关系的叙述不正确的是( )
A.c(Na+)>c(HC2O4—)>c(C2O42—)>c(H2C2O4)
B.c(Na+)=c(HC2O4—)+c(C2O42—)+c(H2C2O4)
C.c(Na+)+c(H+)=c(HC2O4—)+c(C2O42—)+c(OH-)
D.c(H+)+c(H2C2O4)=c(C2O42—)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三甲胺N(CH3)3是重要的化工原料。最近我国科学家实现了使用铜催化剂将N,N—二甲基甲酰胺(N(CH3)2NCHO,简称DMF)转化为三甲胺的合成路线。回答下列问题:
(1)结合实验与计算机模拟结果,研究单一DMF分子在铜催化剂表面的反应历程,如图所示:
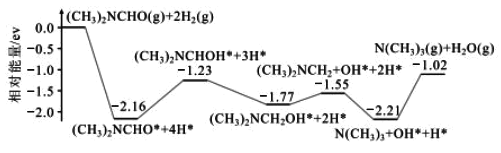
该历程中最大能垒(活化能)=__eV,该步骤的化学方程式为__。
(2)该反应变化的ΔH__0(填“<”、“>”或“=”),制备三甲胺的热化学方程式为__。
(3)160℃时,将DMF(g)和H2(g)以物质的量之比为1:2充入盛有催化剂的刚性容器中,容器内起始压强为p0,达到平衡时DMF的转化率为25%,则该反应的平衡常数Kp=__(Kp为以分压表示的平衡常数);能够增大DMF平衡转化率同时加快反应速率的操作是__。
(4)三甲胺是鱼腥臭的主要来源,是判断海水鱼类鲜度的化学指标之一。通过传感器产生的电流强度可以监测水产品中三甲胺的含量,一种燃料电池型三甲胺气体传感器的原理如图所示。外电路的电流方向为__(填“a→b”或“b→a”),负极的电极反应式为__。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com