
【题目】在一体积固定的密闭容器中加入反应物A、B,发生如下反应:A(g)+2B(g)![]() 3C(g)。反应过程中的部分数据如下表所示:下列说法正确的是( )
3C(g)。反应过程中的部分数据如下表所示:下列说法正确的是( )
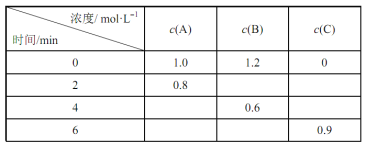
A.在0~2min内,B的反应速率为0.1mol·Lˉ1·minˉ1
B.2min时,C的物质的量浓度为0.4mol·L-1
C.4min时,反应已达到平衡状态,此时正、逆反应的速率都为0
D.在4~6min内,容器内气体分子的总物质的量不变
科目:高中化学 来源: 题型:
【题目】由短周期前10号元素组成的物质T和X,如图所示的转化。X不稳定,易分解。为使得下列转化能够成功进行,方框内不可能加入的反应试剂是 ( )
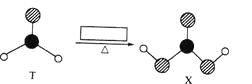
A.Ag(NH3)2OHB.溴水
C.酸性KMnO4溶液D.NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO3-+5SO32-+2H+=I2+5SO42-+H2O,生成的I2可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
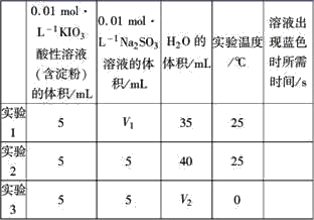
该实验的目的是_________;表中V2=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C中均含有10个电子。它们之间转化关系如图所示。下列说法正确的是( )
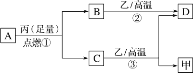
A.原子半径:Z>Y>X
B.X与Y形成的化合物只含共价键,能形成原子晶体
C.Y有多种同素异形体,且均具有高熔点、高沸点、硬度大的性质
D.气态氢化物的稳定性:A<C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据能量变化示意图,下列说法正确的是( )

A. 状态1是液态,则状态3一定是气态
B. 状态3是液态,则状态4一定是气态
C. A(状态2)+B(g)═C(状态3)+D(g)△H=(d﹣a)kJmol﹣1
D. 断裂1molC(状态3)和1molD(g)中的化学键需要吸收的能量为(e﹣d)kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“酒是陈的香”是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:
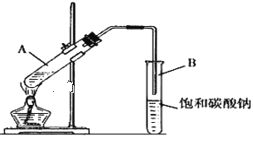
(1)装置B中导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是__;饱和碳酸钠溶液的作用是___(选字母,可多选)
A.中和乙酸 B.溶解乙醇 C.降低乙酸乙酯的溶解度 D.提高产量
(2)该反应属于__(选字母,可多选)。
A.加成反应 B.取代反应 C.水解反应 D.酯化反应
(3)写出上述制取乙酸乙酯反应的化学反应方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气变换反应的能量变化如图。下列叙述错误的是
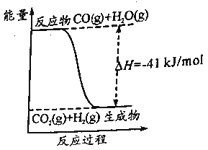
A.反应为:CO(g)+H2O(g)=CO2(g)+H2(g)B.反应物总能量高于生成物总能量
C.H2的燃烧热为41 kJ·mol-1D.使用催化剂可以降低反应所需活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的回收与利用是科学家研究的热点课题,可利用CH4与CO2制备“合成气”(CO、H2),还可制备甲醇、二甲醚、低碳烯烃等燃料产品。
I.制合成气
科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g)![]() C(ads)+2H2 (g) (慢反应)
C(ads)+2H2 (g) (慢反应)
反应②:C(ads)+ CO2(g)![]() 2CO(g) (快反应)
2CO(g) (快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
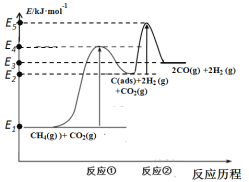
(1)CH4与CO2制备“合成气”的热化学方程式为_________。能量变化图中:E5+E1_________E4+E2(填“>”、“<”或“=”)。
II.脱水制醚
利用“合成气”合成甲醇后,甲醇脱水制得二甲醚的反应为:
2CH3OH(g)![]() CH3OCH3(g) + H2O(g) ΔH,其速率方程式为:v正= k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、k逆为速率常数且只与温度有关。经查阅资料,上述反应平衡状态下存在计算式:lnKc = 2.205+
CH3OCH3(g) + H2O(g) ΔH,其速率方程式为:v正= k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、k逆为速率常数且只与温度有关。经查阅资料,上述反应平衡状态下存在计算式:lnKc = 2.205+![]() (Kc为化学平衡常数;T 为热力学温度,单位为K)。
(Kc为化学平衡常数;T 为热力学温度,单位为K)。
(2)反应达到平衡后,仅升高温度,k正增大的倍数_________ k逆增大的倍数(填“>”、“<”或“=”)。
(3)某温度下(该反应平衡常数Kc为200),在密闭容器中加入一定量 CH3OH,反应到某时刻测得各组分的物质的量如下:
物质 | CH3OH | CH3OCH3 | H2O |
物质的量/mol | 0.4 | 0.4 | 0.4 |
此时正、逆反应速率的大小:v正 ____v逆 (填“>”、 “<”或“=”)。
(4)500K下,在密闭容器中加入一定量甲醇 CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为_________(填标号)。
A <![]() B
B ![]() C >
C >![]() D 无法确定
D 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍的全球消费量仅次于铜、铝、铅、锌,居有色金属第五位,常用于各种高光泽装饰漆和塑料生产,也用作催化剂,制取原理:Ni(CO)4(g)![]() Ni(s)+4CO(g),实验室用如图所示装置制取 Ni(CO)4。
Ni(s)+4CO(g),实验室用如图所示装置制取 Ni(CO)4。

已知:CO + PdCl2 + H2O = CO2 + Pd↓(黑色) + 2HCl;Ni(CO)4 熔点-25℃,沸点 43℃,60℃以上与空气混合易爆炸;Fe(CO)5 熔点-20℃,沸点 103℃。回答下列问题:
(1)装置 A 中发生反应的化学方程式为_____。
(2)装置 C 用于合成 Ni(CO)4(夹持装置略),最适宜选用的装置为________(填标号)。
① ②
②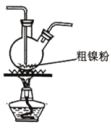 ③
③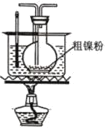
(3)实验过程中为了防止_________,必须先观察________(填实验现象)再加热 C 装置。
(4)利用“封管实验”原理可获得(高纯镍。如图所示的石英)玻璃封管中充有 CO 气体,则高纯镍粉在封管的________温度区域端生成 填“323K”或“473K” 。

(5)实验中加入 11.50 g HCOOH,C 装置质量减轻 2.95 g(设杂质不参加反应),E 装置中盛有 PdCl2 溶液100 mL,则 PdCl2 溶液的物质的量浓度至少为________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com