
【题目】科学家研发出一种新型水溶液锂电池,采用复合膜包裹的金属锂作负极,锰酸锂(LiMn2O4)作正极,以0.5 mol/Li2SO4 水溶液作电解质溶液。电池充、放电时,LiMn2O4与Li2Mn2O4可以相互转化。下列有关该电池的说法正确的是
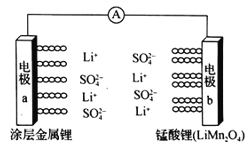
A. 该电池放电时,溶液中的SO42-向电极b移动
B. 该电池负极的电极反应式为:2Li+2H2O==2LiOH+H2↑
C. 电池充电时,外加直流电源的正极与电极a相连
D. 电池充电时,阳极的电极反应式为:Li2Mn2O4-e-==LiMn2O4 +Li+
科目:高中化学 来源: 题型:
【题目】中国科学院深圳研究院成功研发出一种基于二硫化钼/碳纳米复合材料的钠型双离子电池,可充放电。其放电时工作原理如图所示。下列说法不正确的是( )

A.二硫化钼/碳纳米复合材料为该电池的负极材料
B.放电时正极的反应式为Cn(PF6)x+xe-═xPF6-+Cn
C.充电时阴极的电极反应式为MoS2-C+xNa++xe-=NaxMoS2-C
D.充电时石墨端铝箔连接外接电源的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生…… |
下列对实验现象的解释或推测不合理的是( )
A. a、d处:2H2O+2e-=H2↑+2OH- B. b处:2Cl--2e-=Cl2↑
C. c处发生了反应:Fe-2e-=Fe2+ D. 根据实验一的原理,实验二中m处能析出铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )

A. 在t℃时,Ag2CrO4的Ksp为1×10-8
B. 在饱和溶液中加入K2CrO4可使溶液由Y点到Z点
C. 在t℃时,Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO42-(aq)平衡常数K=6.25×107
2AgCl(s)+CrO42-(aq)平衡常数K=6.25×107
D. 在t℃时,以0.001mol/L AgNO3溶液滴定20mL 0.001mol/L KCl和0.001mol/L的K2CrO4的混合溶液,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧气、二氧化碳是最常见的气体。回答下列问题:
(1)宇航员呼吸产生的CO2用下列反应处理,实现空间站中的O2循环利用。镍催化剂反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
①已知H2(g)+![]() O2(g)
O2(g)![]() H2O(g)ΔH=-akJ·mol-1,
H2O(g)ΔH=-akJ·mol-1,
CH4(g)+2O2(g)![]() CO2(g)+2H2O(g)ΔH=-bkJ·mol-1。则镍催化剂反应的ΔH=____kJ·mol-1
CO2(g)+2H2O(g)ΔH=-bkJ·mol-1。则镍催化剂反应的ΔH=____kJ·mol-1
②空间站中所涉及的反应有:
a.镍催化剂反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
b.电解水反应:2H2O(l)=2H2(g)+O2(g)
c.模拟呼吸反应:C(s)+O2(g)=CO2(g)
则实现空间站O2循环总反应为____
(2)可用O2将HCl转化为Cl2,实现循环利用:O2(g)+4HCl(g)![]() 2Cl2(g)+2H2O(g)。将1molO2和4molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
2Cl2(g)+2H2O(g)。将1molO2和4molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。

③该反应的速率v=kca(O2)·cb(HCl),k为速率常数),下列说法正确的是____(填标号)。
A.温度升高,k增大
B.使用催化剂,k不变
C.在容器中充入不反应的He,总压增大,k增大
D.平衡后再充入1molO2和4molHCl,k增大
④T1____T2(填“>”或“<”);T1时的转化率____T2时的转化率(填“>”“=”或“<”)。
⑤T1时,HCl的平衡转化率=____;T2反应的Kx=____(Kx为以物质的量分数表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 可用
可用![]() 来检验呈蓝色
来检验呈蓝色![]() 将图I装置中的铁棒末段分别联上一块锌片和铜片,并静置于含有
将图I装置中的铁棒末段分别联上一块锌片和铜片,并静置于含有![]() 及酚酞的混合凝胶上.一段时间后发现凝胶的某些区域(如图)II示发生了变化.则下列说法正确的是
及酚酞的混合凝胶上.一段时间后发现凝胶的某些区域(如图)II示发生了变化.则下列说法正确的是
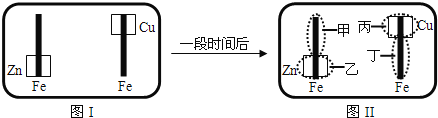
A.甲区不变色B.乙区呈现蓝色
C.丙区产生![]() 离子D.丁区产生
离子D.丁区产生![]() 离子
离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.1871 年门捷列夫最早预言了类硅元素锗,1886 年德国化学家温克勒发现和分离了锗元素,并以其祖国的名字命名为“Ge”。锗是重要的半导体材料,其有机化合物在治疗癌症方面有着独特的功效。下图为工业上利用锗锌矿(主要成分GeO2和ZnS)来制备高纯度锗的流程。
已知:
1.丹宁是一种有机沉淀剂,可与四价锗络合形成沉淀;
2.GeCl4易水解,在浓盐酸中溶解度低。
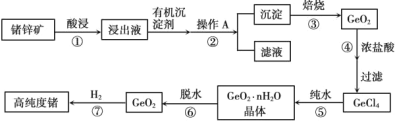
(1)锗元素在周期表中的位置:_____。
(2)步骤②操作A方法是_____。
(3)步骤③中的物质在_____(填仪器名称)中加热。
(4)步骤④不能用稀盐酸,原因可能是_____。
(5)写出步骤⑦的化学方程式_____。
Ⅱ.将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出晶体Cu(NH3)4SO4·H2O。
(1)Cu2+基态核外电子排布式为 _________;1mol [Cu(NH3)4]2+中![]() 键的数目为_______。
键的数目为_______。
(2)SO42-的S原子轨道杂化类型_______________。
(3)NH3极易溶于H2O中,原因为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酚酞为常用的酸碱指示剂,其结构如图所示,下列有关酚酞的说法正确的是
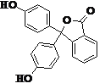
A.含有 3 种官能团
B.可以发生取代反应、消去反应、加成反应、氧化反应
C.分子式为 C20H14O4
D.1 mol 酚酞分别与 NaOH、溴水和 H2 发生反应时,消耗 NaOH、Br2 和 H2 的物质的量的最大值分别为2 mol、4 mol 和10 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型冠状病毒来势汹汹,但是它依然可防可控。84消毒液具有强氧化性,可将冠状病毒外的包膜破坏后使RNA被降解,使病毒失活,以达到灭菌的效果。制取84消毒液的氯气可用加热浓盐酸和MnO2混合物来制取,也可用浓盐酸和KClO3直接混合来制取。回答下列问题:
(1)在周期表中与Mn相邻且未成对电子数最多的原子的价电子排布式为:___。
(2)K和O第一电离能I1(K)___I1(O)(填“大于”或“小于”)。原因是___。
(3)浓盐酸为HCl的水溶液,HCl极易溶于水的原因___,HCl和H2O中沸点较高的是___,其原因是___。
(4)KClO3晶体中,阴离子的空间构型为___,Cl的杂化轨道与O的2p轨道形成___键。
(5)金属K晶体为体心立方堆积,K原子半径为rpm,摩尔质量为Mg·mol-1,阿伏加德罗常数为NA,则晶体密度为___g﹒cm-3。(列出计算式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com