
【题目】已知![]() 可用
可用![]() 来检验呈蓝色
来检验呈蓝色![]() 将图I装置中的铁棒末段分别联上一块锌片和铜片,并静置于含有
将图I装置中的铁棒末段分别联上一块锌片和铜片,并静置于含有![]() 及酚酞的混合凝胶上.一段时间后发现凝胶的某些区域(如图)II示发生了变化.则下列说法正确的是
及酚酞的混合凝胶上.一段时间后发现凝胶的某些区域(如图)II示发生了变化.则下列说法正确的是
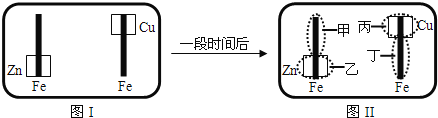
A.甲区不变色B.乙区呈现蓝色
C.丙区产生![]() 离子D.丁区产生
离子D.丁区产生![]() 离子
离子
【答案】D
【解析】
铁棒末段分别联上一块锌片和铜片,并静置于含有K3Fe(CN)6及酚酞的混合凝胶上,则形成原电池装置,活泼金属为负极,甲区发生电极反应:O2+2H2O+4e-=4OH-,乙区发生电极反应:2Zn-4e-=2Zn2+,丙区发生电极反应:O2+2H2O+4e-=4OH-,丁区发生电极反应:2Fe-4e-=2Fe2+,根据电极反应式来判断各个电极的变化情况。
A.甲区发生电极反应:O2+2H2O+4e-=4OH-,生成的氢氧根离子能使酚酞变红色,所以甲极区变红色,故A错误;
B.乙区发生电极反应:2Zn-4e-=2Zn2+,所以乙极区不变色,故B错误;
C.丙区发生电极反应:O2+2H2O+4e-=4OH-,不会产生铜离子,故C错误;
D.丁区发生电极反应:2Fe-4e-=2Fe2+,故D正确;
故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有的油田开采的石油中溶有一种碳氢化合物—金刚烷。金刚烷 是一种环状烃,它的结构高度对称。下图表示金刚烷,图中数字是碳原子编号。碳原子用小黑点表示,氢原子均省略,一条短线表示共用一对电子。
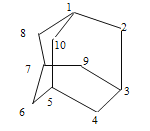
(1)编号1的碳原子上的一个氢原子被氨基(-NH2)取代后,再与盐酸反应生成盐酸盐(1—氨基金刚烷盐酸盐)是一种防治感冒的药物。推断它的化学式是__________。
(2)金刚烷是由 _____ 个六元环构成的笼形结构,其中有 _____ 个碳原子被三个环共有。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.短周期元素X、Y、Z在元素周期表中的位置如图所示,回答下列问题。
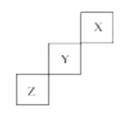
(1)元素X单质分子是________![]() 写化学式
写化学式![]() 。
。
(2)![]() 在元素周期表中的第________周期第________族。
在元素周期表中的第________周期第________族。
(3)Z的同主族下一周期的元素的原子序数是________。
Ⅱ.填写下列空白:
(1)写出表示含有6个质子、8个中子的原子的化学符号:________![]()
(2)周期表中所含元素种数最多的纵行是第________纵行。
(3)周期表中铁元素的位置 _____。
(4)周期表中原子序数为87的元素的位置_______________。
(5)已知A、B为同主族相邻周期的元素,原子序数![]() ,其中元素A位于第六周期,其原子序数为m,若为第ⅡA族,则B原子序数为 __________.
,其中元素A位于第六周期,其原子序数为m,若为第ⅡA族,则B原子序数为 __________.
(6)由![]() ,D,T和
,D,T和![]() ,
,![]() ,
,![]() 共可以组成________种水分子。
共可以组成________种水分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研发出一种新型水溶液锂电池,采用复合膜包裹的金属锂作负极,锰酸锂(LiMn2O4)作正极,以0.5 mol/Li2SO4 水溶液作电解质溶液。电池充、放电时,LiMn2O4与Li2Mn2O4可以相互转化。下列有关该电池的说法正确的是
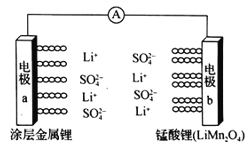
A. 该电池放电时,溶液中的SO42-向电极b移动
B. 该电池负极的电极反应式为:2Li+2H2O==2LiOH+H2↑
C. 电池充电时,外加直流电源的正极与电极a相连
D. 电池充电时,阳极的电极反应式为:Li2Mn2O4-e-==LiMn2O4 +Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工原料水合肼(N2H4·H2O)是一种强还原性的碱性液体。
Ⅰ.实验室用下图装置制备水合肼(N2H4·H2O)。
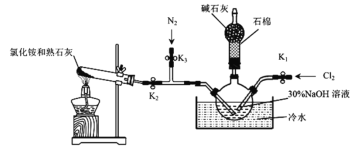
实验步骤:关闭K2、K3,打开K1,制备 NaClO;关闭K1、K2,打开K3,通入N2一段时间;关闭K3,打开K2,点燃酒精灯。回答下列问题:
(1)盛放碱石灰的仪器的名称为___________________。
(2)配制30%NaOH溶液时,所需玻璃仪器有烧杯、玻璃棒、胶头滴管和_________。
(3)步骤2中通入N2一段时间的原因是____________________________________。
(4)水槽中放入冷水的目的是_____________________________________________。
(5)NH3与 NaClO反应生成N2H4·H2O的化学方程式为_______________________。
Ⅱ.已知:N2H4·H2O+2I2=N2↑+4HI+H2O,测定水合肼粗产品的纯度步骤如下:
a.称取N2H4·H2O粗产品(其它杂质不与I2反应)2.000g。
b.加水配成250.00mL溶液。
c.移出25.00mL置于锥形瓶中,滴加几滴淀粉溶液。
d.用0.3000mol·L-1的碘标准溶液进行滴定。
e.重复上述操作两次。三次测定数据如下表:
实验序号 | 1 | 2 | 3 |
消耗碘标准溶体积/mL | 20.24 | 20.02 | 19.98 |
f.数据处理。
(6)碘标准溶液盛放在____________(填“酸式”或“碱式”)滴定管中。在滴定管中装入碘标准溶的前一步,应进行的操作为_________,达到终点的现象是__________。
(7)消耗的碘标准溶平均体积为______mL,粗产品中水合肼的质量分数为______。
(8)判断下列操作对测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①若在配制碘标准溶液时,烧杯中的溶液有少量溅出,则测定结果___________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )
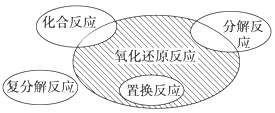
A.Cl2+2KBr=Br2+2KClB.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O=4Fe(OH)3D.2Na2O2+2CO2=2Na2CO3+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某条件下,某气态烃的混合气体 0.1mol,完全燃烧后生成 4.05 g 水和 0.15 mol CO2,该 烃的组成为
①CH4、C2H4 ②C2H6、C2H4 ③CH4、C3H6 ④C2H6、C3H6 ⑤CH4、C2H6 ⑥CH4、C3H8
A.①②B.③④C.③⑤⑥D.③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色 气泡后,迅速停止 | Fe、Cu接触后,其表面 均产生红棕色气泡 |
下列说法中,不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com