
【题目】Ⅰ.1871 年门捷列夫最早预言了类硅元素锗,1886 年德国化学家温克勒发现和分离了锗元素,并以其祖国的名字命名为“Ge”。锗是重要的半导体材料,其有机化合物在治疗癌症方面有着独特的功效。下图为工业上利用锗锌矿(主要成分GeO2和ZnS)来制备高纯度锗的流程。
已知:
1.丹宁是一种有机沉淀剂,可与四价锗络合形成沉淀;
2.GeCl4易水解,在浓盐酸中溶解度低。
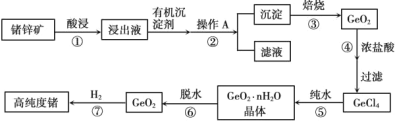
(1)锗元素在周期表中的位置:_____。
(2)步骤②操作A方法是_____。
(3)步骤③中的物质在_____(填仪器名称)中加热。
(4)步骤④不能用稀盐酸,原因可能是_____。
(5)写出步骤⑦的化学方程式_____。
Ⅱ.将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出晶体Cu(NH3)4SO4·H2O。
(1)Cu2+基态核外电子排布式为 _________;1mol [Cu(NH3)4]2+中![]() 键的数目为_______。
键的数目为_______。
(2)SO42-的S原子轨道杂化类型_______________。
(3)NH3极易溶于H2O中,原因为______________________。
【答案】第四周期第ⅣA族 过滤 坩埚 HCl浓度大可抑制四价锗水解,使GeO2充分反应,获得GeCl4沉淀 GeO2+2H2![]() Ge+2H2O 1s22s22p63s23p63d9 或[Ar]3d9 16NA sp3 NH3与H2O之间能形成氢键
Ge+2H2O 1s22s22p63s23p63d9 或[Ar]3d9 16NA sp3 NH3与H2O之间能形成氢键
【解析】
酸浸锗锌矿,浸出液中含有四价锗离子和锌离子,加入有机沉淀剂丹宁与四价锗络合形成沉淀,过滤后得到含有锗的沉淀,将沉淀焙烧得到GeO2;用浓盐酸溶解GeO2生成GeCl4,GeCl4在浓盐酸中溶解度低,过滤得GeCl4;GeCl4在纯水中水解生成GeO2·nH2O,GeO2·nH2O脱水后得到较纯净的GeO2,用氢气加热还原GeO2得到高纯度Ge,据此解答。
Ⅰ. (1)Ge与Si都是常见的半导体材料,Ge与Si同属第ⅣA族元素,且Ge在Si的下一周期,即锗在第四周期第ⅣA族,故答案为:第四周期第ⅣA族;
(2)经过步骤②操作A得到沉淀和滤液,所以,该操作方法是过滤,故答案为:过滤;
(3)焙烧在坩埚中进行,故答案为:坩埚;
(4)HCl浓度大可抑制四价锗水解,使GeO2充分反应,同时GeCl4在浓盐酸中溶解度低,易获得GeCl4沉淀,故答案为:HCl浓度大可抑制四价锗水解,使GeO2充分反应,获得GeCl4沉淀;
(5)用氢气加热还原GeO2得到高纯度Ge,反应的方程式为:GeO2+2H2![]() Ge+2H2O,故答案为:GeO2+2H2
Ge+2H2O,故答案为:GeO2+2H2![]() Ge+2H2O;
Ge+2H2O;
Ⅱ.(1)Cu是29号元素,Cu2+核外有27个电子,Cu2+基态核外电子排布式为:1s22s22p63s23p63d9 或[Ar]3d9,1个[Cu(NH3)4]2+中含12个N-H键,4个配位键,配位键和N-H键都属于![]() 键,所以,1mol[Cu(NH3)4]2+中含12+4=16mol
键,所以,1mol[Cu(NH3)4]2+中含12+4=16mol![]() 键,即1mol[Cu(NH3)4]2+含16NA
键,即1mol[Cu(NH3)4]2+含16NA![]() 键,故答案为:16NA;
键,故答案为:16NA;
(2)SO42-的中心原子S的![]() 键数=4,孤电子对数=
键数=4,孤电子对数=![]() =0,则S的价层电子对数=4+0=4,故SO42-的中心S原子的轨道杂化类型为sp3杂化,故答案为:sp3;
=0,则S的价层电子对数=4+0=4,故SO42-的中心S原子的轨道杂化类型为sp3杂化,故答案为:sp3;
(3)NH3和H2O之间能形成氢键,导致NH3易溶于H2O中,故答案为:NH3与H2O之间能形成氢键。


科目:高中化学 来源: 题型:
【题目】工业上常采用“电催化氧化—化学沉淀法”对化学镀镍废水进行处理,电解过程中电解槽中H2O、Cl-放电产生·OH、HClO,在活性组分作用下,阴阳两极区发生的反应如下(R表示有机物):
①R+·OH→CO2+H2O
②R+HClO→CO2+H2O+Cl-
③H2PO![]() +2·OH-4e-=PO
+2·OH-4e-=PO![]() +4H+
+4H+
④HPO![]() +·OH-2e-=PO
+·OH-2e-=PO![]() +2H+
+2H+
⑤H2PO![]() +2ClO-=PO
+2ClO-=PO![]() +2H++2Cl-
+2H++2Cl-
⑥HPO![]() +ClO-=PO
+ClO-=PO![]() +H++Cl-
+H++Cl-
⑦Ni2++2e-=Ni
⑧2H++2e-=H2↑
下列说法不正确的是( )
A.·OH、HClO在阳极上产生
B.增大电极电压,电化学氧化速率加快
C.电解时,阴极附近pH逐渐升高,Ni2+去除率逐渐减小
D.向电解后的废水中加入CaCl2可以去除磷元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K、25℃,在NaHS溶液中,各离子的浓度随NaHS溶液浓度的变化关系如图所示,下列叙述不正确的是
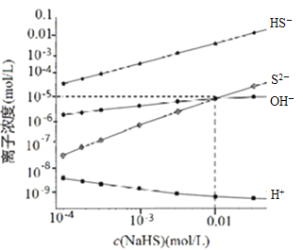
已知:298K(25℃)H2S的Ka1=9.10×10-8,Ka2=1.10×10-12。
A.0.10mol/LNaHS溶液:c(Na+)>c(HS)>c(S2)>c(OH)>c(H+)
B.Na2S溶液中:c(Na+)=2c(S2)+2c(HS)+2c(H2S)
C.随着c(NaHS)浓度的增大c(H+)也将持续增大
D.当c(OH)=c(S2)时,c(H+)=10-9mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研发出一种新型水溶液锂电池,采用复合膜包裹的金属锂作负极,锰酸锂(LiMn2O4)作正极,以0.5 mol/Li2SO4 水溶液作电解质溶液。电池充、放电时,LiMn2O4与Li2Mn2O4可以相互转化。下列有关该电池的说法正确的是
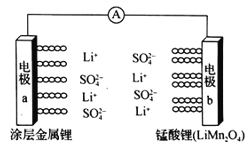
A. 该电池放电时,溶液中的SO42-向电极b移动
B. 该电池负极的电极反应式为:2Li+2H2O==2LiOH+H2↑
C. 电池充电时,外加直流电源的正极与电极a相连
D. 电池充电时,阳极的电极反应式为:Li2Mn2O4-e-==LiMn2O4 +Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料。
(1)以下是工业上合成甲醇的反应:![]()
![]() 下表所列数据是该反应在不同温度下的化学平衡常数
下表所列数据是该反应在不同温度下的化学平衡常数![]() .
.
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断反应I为 ______ 热反应(填“吸”或“放”) ![]() 某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得
某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得![]() ,则CO的转化率为 ______ ,此时的温度为 ______ 从表中选择.
,则CO的转化率为 ______ ,此时的温度为 ______ 从表中选择.
(2)已知在常温常压下:
①![]()
②![]()
③![]()
则反应![]() ______
______ ![]() 用
用![]() 、
、![]() 、
、![]() 表示
表示
(3)处理废水时,最后![]() 以
以![]() 形式除去,当
形式除去,当![]() 时,
时,![]() 沉淀完全,此时溶液的
沉淀完全,此时溶液的![]() ______ (已知,
______ (已知,![]() ,
,![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )
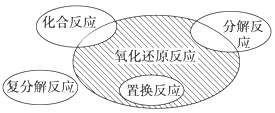
A.Cl2+2KBr=Br2+2KClB.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O=4Fe(OH)3D.2Na2O2+2CO2=2Na2CO3+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到实验目的的是( )
A. 实验室制取氨气
实验室制取氨气
B.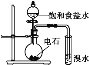 证明乙炔可使溴水褪色
证明乙炔可使溴水褪色
C.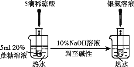 检验蔗糖的水解产物具有还原性
检验蔗糖的水解产物具有还原性
D.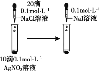 证明溶解度:AgCl>AgI
证明溶解度:AgCl>AgI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成![]() 。
。
回答下列问题:
(1)写出锌和氢氧化钠溶液反应的化学方程式
_________________________________________________________________。
(2)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是________。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水
③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(3)写出可溶性铝盐与氨水反应的离子方程式
_________________________________________________________________。
(4)试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因
__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于碱金属元素的说法正确的是( )
①原子结构的相同点是最外层电子数相同,都为1
②原子结构的不同点是随核电荷数的增加,电子层数增多,原子半径增大
③具有相似的化学性质,都是活泼金属
④都具有强还原性,在化合物中显![]() 价
价
⑤化学性质有差别,从Li到Cs,失电子能力逐渐增强
A.①③④B.①③⑤C.②④⑤D.①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com