
【题目】下列实验不能达到实验目的的是( )
A. 实验室制取氨气
实验室制取氨气
B.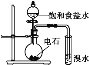 证明乙炔可使溴水褪色
证明乙炔可使溴水褪色
C.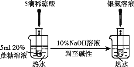 检验蔗糖的水解产物具有还原性
检验蔗糖的水解产物具有还原性
D.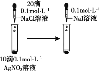 证明溶解度:AgCl>AgI
证明溶解度:AgCl>AgI
【答案】B
【解析】
A. 该图为实验室制用氯化铵和氢氧化钙取氨气的实验装置图,故A正确;
B. 得到的乙炔中含有硫化氢等气体,硫化氢等气体也能使溴水褪色,应该先将得到的气体通入硫酸铜溶液除去杂质,然后将得到的气体通入溴水检验乙炔,故B错误;
C. 检验蔗糖水解产物葡萄糖具有还原性:蔗糖在酸性条件下水解后的溶液中先加入适量稀NaOH溶液中和,再加入新制的银氨溶液并水浴加热,在加入银氨溶液之前必须加入NaOH溶液中和未反应的稀硫酸,否则稀硫酸和银氨溶液反应而得不到Ag,故C正确;
D. 向AgNO3溶液中滴加少量NaCl溶液,然后再向其中滴加KI溶液,先生成白色沉淀,后生成黄色沉淀,说明AgI更难溶,溶度积越小其溶解度越小,则溶解度:AgCl>AgI,故D正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】0.2molNaOH和0.1molCa(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为6.72L(标准状况)时立即停止,则这一过程中,溶液中离子数目和通入CO2气体的体积关系正确的图像是(气体的溶解忽略不计)
A. B.
B.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧气、二氧化碳是最常见的气体。回答下列问题:
(1)宇航员呼吸产生的CO2用下列反应处理,实现空间站中的O2循环利用。镍催化剂反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
①已知H2(g)+![]() O2(g)
O2(g)![]() H2O(g)ΔH=-akJ·mol-1,
H2O(g)ΔH=-akJ·mol-1,
CH4(g)+2O2(g)![]() CO2(g)+2H2O(g)ΔH=-bkJ·mol-1。则镍催化剂反应的ΔH=____kJ·mol-1
CO2(g)+2H2O(g)ΔH=-bkJ·mol-1。则镍催化剂反应的ΔH=____kJ·mol-1
②空间站中所涉及的反应有:
a.镍催化剂反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
b.电解水反应:2H2O(l)=2H2(g)+O2(g)
c.模拟呼吸反应:C(s)+O2(g)=CO2(g)
则实现空间站O2循环总反应为____
(2)可用O2将HCl转化为Cl2,实现循环利用:O2(g)+4HCl(g)![]() 2Cl2(g)+2H2O(g)。将1molO2和4molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
2Cl2(g)+2H2O(g)。将1molO2和4molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。

③该反应的速率v=kca(O2)·cb(HCl),k为速率常数),下列说法正确的是____(填标号)。
A.温度升高,k增大
B.使用催化剂,k不变
C.在容器中充入不反应的He,总压增大,k增大
D.平衡后再充入1molO2和4molHCl,k增大
④T1____T2(填“>”或“<”);T1时的转化率____T2时的转化率(填“>”“=”或“<”)。
⑤T1时,HCl的平衡转化率=____;T2反应的Kx=____(Kx为以物质的量分数表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.1871 年门捷列夫最早预言了类硅元素锗,1886 年德国化学家温克勒发现和分离了锗元素,并以其祖国的名字命名为“Ge”。锗是重要的半导体材料,其有机化合物在治疗癌症方面有着独特的功效。下图为工业上利用锗锌矿(主要成分GeO2和ZnS)来制备高纯度锗的流程。
已知:
1.丹宁是一种有机沉淀剂,可与四价锗络合形成沉淀;
2.GeCl4易水解,在浓盐酸中溶解度低。
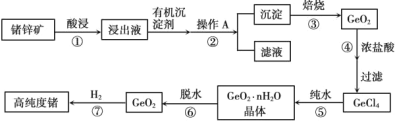
(1)锗元素在周期表中的位置:_____。
(2)步骤②操作A方法是_____。
(3)步骤③中的物质在_____(填仪器名称)中加热。
(4)步骤④不能用稀盐酸,原因可能是_____。
(5)写出步骤⑦的化学方程式_____。
Ⅱ.将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出晶体Cu(NH3)4SO4·H2O。
(1)Cu2+基态核外电子排布式为 _________;1mol [Cu(NH3)4]2+中![]() 键的数目为_______。
键的数目为_______。
(2)SO42-的S原子轨道杂化类型_______________。
(3)NH3极易溶于H2O中,原因为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.常温常压下,11.2LCO2所含的原子数为1.5NA
B.常温下,46gNO2和N2O4的混合物中含有的氮原子数为NA
C.1L0.5mol·L-lFeCl3溶液完全转化可制得0.5NA个Fe(OH)3胶粒
D.1molNa被完全氧化生成Na2O2,失去2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酚酞为常用的酸碱指示剂,其结构如图所示,下列有关酚酞的说法正确的是
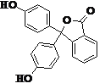
A.含有 3 种官能团
B.可以发生取代反应、消去反应、加成反应、氧化反应
C.分子式为 C20H14O4
D.1 mol 酚酞分别与 NaOH、溴水和 H2 发生反应时,消耗 NaOH、Br2 和 H2 的物质的量的最大值分别为2 mol、4 mol 和10 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淡黄色固体A和气体X存在如下转化关系:请回答下列问题:

(1)固体A的名称___。
(2)将39克固体A投入到69克水中完全反应产生的气体在标准状况下的体积为多少毫升___?所得溶液的质量分数是多少___?(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙是一种温和的氧化剂,常温下为白色的固体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。某实验小组拟选用如下装置(部分固定装置略)制备过氧化钙。

(1)请选择必要的装置,按气流方向连接顺序为_____(填仪器接口的字母编号,装置可重复使用)。
实验步骤如下:
①检验装置的气密性后,装入药品;
②打开分液漏斗活塞通入一段时间气体,加热药品;
③反应结束后,熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞;
④拆除装置,取出产物。
(2)一小组同学利用CaCl2在碱性条件下与H2O2反应制得。制备CaO2的实验方案和装置示意图如下:
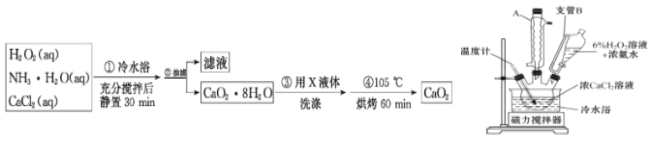
①三颈烧瓶中发生的主要反应的化学方程式为______________________________。
②支管B的作用是_____。
③步骤③中洗涤CaO2·8H2O的液体X 的最佳选择是_____;
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
④该反应常用冰水浴控制温度在0℃左右,其可能的原因该反应是放热反应,温度低有利于提高CaO2·8H2O产率;_____。
(3)测定产品中CaO2 含量的实验步骤如下:
步骤一:准确称取a g 产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI 晶体,再滴入少量2 mol·L-1的硫酸,充分反应。
步骤二:向上述锥形瓶中加入几滴_____(作指示剂)。
步骤三:逐滴加入浓度为 c mol·L-1 的 Na2S2O3 溶液至反应完全,滴定至终点,记录数据,再重复上述操作2次,得出三次平均消耗Na2S2O3 溶液的体积为V mL。CaO2的质量分数为 _________(用字母表示)。(已知:I2+ 2S2O32-=2I-+ S4O62-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图Ⅰ是NO2(g)+CO(g)![]() CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态,当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。
CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态,当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。
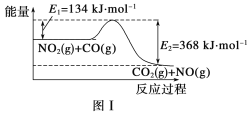

下列有关说法正确的是( )
A.一定条件下,向密闭容器中加入1molNO2(g)与1molCO(g)反应放出234kJ热量
B.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
C.若X表示温度,则Y表示的可能是CO2的物质的量浓度
D.若X表示反应时间,则Y表示的可能是混合气体的密度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com