
����Ŀ��SPC��2Na2CO33H2O2����Na2CO3��H2O2��˫�����ʣ��㷺Ӧ����ӡȾ��ҽҩ������������â����Na2SO410H2O����H2O2��Ϊԭ���Ʊ�SPC�Ĺ����������£�
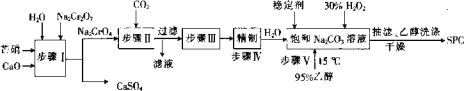
�ش��������⣺
��1������I��_____��������������û����������������ԭ��Ӧ��
��2������II�л�����һ�ֿ���ѭ��ʹ�õ����ʣ������ʵĻ�ѧʽΪ_____��
��3�����������Ҫ���ȣ�������Ӧ�Ļ�ѧ����ʽΪ______��
��4��������У��ϳ�ʱ��ѡ���¶�Ϊ15�棬��Ŀ����_____���ӻ��������ĽǶȿ���ڶ�����д��ڵ�ȱ����_______��
��5��SPC�ı��淽����________��
��6�����������ô������ֽ�ʱ����ˮ����ԭ�ӣ�����ԭ�ӷdz����ã���Ϊ������������0.1600 g��Ʒ�� ����250 mL��ƿ�У�����100 mL 0. 5 molL-1�����ܽ���ȫ��������0.02000molL-1KMnO4����Һ�ζ����ζ����յ�ʱ��Һ��ɫΪ_____���Ұ�����ڲ��ָ�Ϊԭ������ɫ����������ƽ��ʵ�飬����KMnO4��Һ��ƽ�����Ϊ26.56 mL�����⣬�ڲ�����Ʒ������°����������̽��пհ�ʵ�飬����KMnO4��Һ��ƽ�����Ϊ2.24 mL������Ʒ�Ļ���������Ϊ______%��
���𰸡�û�� Na2Cr2O7 2NaHCO3![]() Na2CO3+H2O+CO2�� �¶ȵ���15�棬��Ӧ���������¶ȸ���15�棬�������������ֽ� ���������˸����ƣ�+6�۸��ж�������ɻ�����Ⱦ ���¡��ܹ⡢�ܷⱣ�� dz��ɫ 12.16
Na2CO3+H2O+CO2�� �¶ȵ���15�棬��Ӧ���������¶ȸ���15�棬�������������ֽ� ���������˸����ƣ�+6�۸��ж�������ɻ�����Ⱦ ���¡��ܹ⡢�ܷⱣ�� dz��ɫ 12.16
��������
â����Na2SO410H2O����CaO�м�ˮ���ټ���Na2Cr2O7������CaSO4�������Һ�м���CO2������2CrO42-+2H+![]() Cr2O72-+H2O����Һ��Na2Cr2O7����ѭ��ʹ�ã������к���̼���ơ�̼�����ƣ���̼�����Ƽ��ȷֽ⣺2NaHCO3
Cr2O72-+H2O����Һ��Na2Cr2O7����ѭ��ʹ�ã������к���̼���ơ�̼�����ƣ���̼�����Ƽ��ȷֽ⣺2NaHCO3![]() Na2CO3+H2O+CO2������ˮ�ܽ�õ�����̼���ƣ�����������⣬�����¶�Ϊ15�棬�Ҵ�ϴ�ӣ������SPC��
Na2CO3+H2O+CO2������ˮ�ܽ�õ�����̼���ƣ�����������⣬�����¶�Ϊ15�棬�Ҵ�ϴ�ӣ������SPC��
��1������I�з�Ӧǰ��Ԫ�ػ��ϼ�û�����ı䣬û����������ԭ��Ӧ���ʴ�Ϊ��û�У�
��2����Һ�е���Ҫ�ɷֿ���ѭ��ʹ�ã����ݷ����ɵ���Һ�к��и�Ԫ�أ���2CrO42-+2H+![]() Cr2O72-+H2O�����ѭ������Ϊ��
Cr2O72-+H2O�����ѭ������Ϊ��
Na2Cr2O7���ʴ�Ϊ��Na2Cr2O7��
��3������������ɵ�̼�������ܽ�Ƚ�С�����ȷֽ⣺2NaHCO3![]() Na2CO3+H2O+CO2�����ʴ�Ϊ��2NaHCO3
Na2CO3+H2O+CO2�����ʴ�Ϊ��2NaHCO3![]() Na2CO3+H2O+CO2����
Na2CO3+H2O+CO2����
��4���¶ȵ���15�棬��Ӧ���������¶ȸ���15�棬�������������ֽ⣬���������˸����ƣ�+6�۸��ж�������ɻ�����Ⱦ���ʴ�Ϊ���¶ȵ���15�棬��Ӧ���������¶ȸ���15�棬�������������ֽ⣻���������˸����ƣ�+6�۸��ж�������ɻ�����Ⱦ��
��5������˫��ˮ�ֽ⣬����SPCӦ���¡��ܹ⡢�ܷⱣ�棬�ʴ�Ϊ�����¡��ܹ⡢�ܷⱣ�棻
��6���ζ����յ�ʱ��KMnO4��Һ�Թ�������Һ��dz��ɫ�����ݵ�ʧ�����غ㣬��ƽ���ӷ�Ӧ����ʽ��2MnO4-+5H2O2+6H+=2Mn2++
8H2O+5O2�������εζ�ƽ������KMnO4��Һ26.56mL���հ�ʵ�飬����KMnO4��Һ��ƽ�����Ϊ2.24 mL�����ݹ�ϵʽ��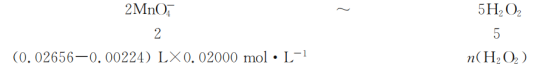
�ã�n(H2O2)=0.001216mol��SPC��Ʒ�Ļ���������Ϊ��![]() ���ʴ�Ϊ��dz��ɫ��12.16��
���ʴ�Ϊ��dz��ɫ��12.16��


 �ǻ�С��ϰϵ�д�
�ǻ�С��ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeCl2��һ�ֳ��õĻ�ԭ����ýȾ����ij��ѧʵ��С����ʵ���������������ַ������Ʊ���ˮFeCl2���й����ʵ��������£�
C6H5Cl(�ȱ��� | C6H4Cl2(���ȱ��� | FeCl3 | FeCl2 | |
�ܽ��� | ������ˮ�������ڱ����Ҵ� | ������C6H5Cl��C6H4Cl2�������������Ҵ�������ˮ | ||
�۵�/�� | -45 | 53 | ������ | |
�е�/�� | 132 | 173 | ---------------------- | -------------------- |
��1��H2��ԭ��ˮFeCl3��ȡFeCl2���й�װ����ͼ��
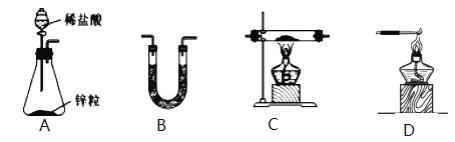
��H2��ԭ��ˮFeCl3��ȡFeCl2�Ļ�ѧ����ʽΪ_____��
�ڰ����������ҵķ�����������������˳��Ϊ_____��������ĸ��װ�ÿɶ��ʹ�ã���B��ʢ�ŵ��Լ���_____��
�۸��Ʊ�װ�õ�ȱ��Ϊ_____��
��2�����÷�Ӧ2FeCl3+C6H5Cl��2FeCl2+C6H4Cl2+HCl������ȡ��ˮFeCl2���ⶨFeCl3��ת���ʡ�����ͼװ�ã���������ƿ�з���32.5g��ˮ�Ȼ����������ȱ������Ʒ�Ӧ�¶���һ����Χ����3h����ȴ�������ᴿ�õ��ֲ�Ʒ��

������a��������_____��
�ڷ�Ӧ��������ȴʵ��װ��A����������ƿ�����ʵ����������ˡ�ϴ�ӡ�����õ��ֲ�Ʒ��ϴ�����õ��Լ�������_____��������Һ��C6H5C1�IJ�����_____��
�۷�Ӧ����ƿ����Һ���250mL����ȡ25.00mL������Һ����0.40mol/L NaOH��Һ�ζ����յ�ʱ����NaOH��ҺΪ19.60mL�����Ȼ�����ת����Ϊ_____��
��Ϊ�˼���ʵ��������ȡ��ˮFeCl2������Ӧ��ȡ�Ĵ�ʩ�У�_____��д��һ�㼴�ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���鼰�仯�������Ź㷺����;���������ֳ��������ᣬ����(H3AsO4)��������(H3AsO3)����֪����(H3AsO4)��pKa1��pKa2��pKa3����Ϊ2.25��6.77��11.40(pKa����lgKa)���ش��������⣺
(1)��֪��As(s)��![]() H2(g)��2O2(g)=H3AsO4(s)����H1
H2(g)��2O2(g)=H3AsO4(s)����H1
H2(g)��![]() O2(g)=H2O(l)����H2
O2(g)=H2O(l)����H2
As(s)��![]() O2(g)=
O2(g)=![]() As2O5(s)����H3
As2O5(s)����H3
��ӦAs2O5(s)��3H2O(l)=2H3AsO4(s)����H��______��
(2)д������(H3AsO4)�ĵڶ������뷽��ʽ_______��
(3)NaH2AsO4��Һ��___(����ԡ������ԡ����ԡ�)����ͨ������˵��_______��
(4)������(H3AsO3)ˮ��Һ�д��ڶ�������̬���������ֲ�����(ƽ��ʱij���ֵ�Ũ��ռ������Ũ��֮�͵ķ���)����Һ��pH��ϵ��ͼ��ʾ��
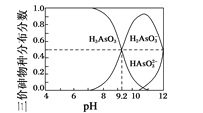
�Է�̪Ϊָʾ��(��ɫ��ΧpH 8.2��10.0)����NaOH��Һ��μ��뵽H3AsO3��Һ�У�����Һ����ɫ��Ϊdz��ɫʱֹͣ�μӡ��ù�������Ҫ��Ӧ�����ӷ���ʽΪ_______��
(5)ij��ѧ��ȤС��ͬѧ��̽�����淴Ӧ��AsO33-��I2��2OH��![]() AsO43-��2I����H2O�����ͼ����ʾװ�á�ʵ�����������ͼ��װ�ü����Լ�������װ�ã�������C2����C1����������Ϊ��ʱ����ͼ��װ������ձ�����μ���һ����2 mol��L��1���ᣬ�����ֲ���������ʵ���е�����ʱ��Ĺ�ϵ��ͼ����ʾ��
AsO43-��2I����H2O�����ͼ����ʾװ�á�ʵ�����������ͼ��װ�ü����Լ�������װ�ã�������C2����C1����������Ϊ��ʱ����ͼ��װ������ձ�����μ���һ����2 mol��L��1���ᣬ�����ֲ���������ʵ���е�����ʱ��Ĺ�ϵ��ͼ����ʾ��
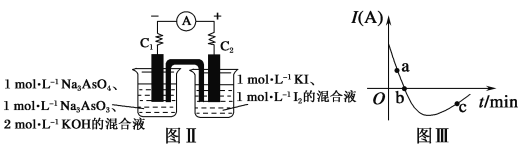
��ͼ����AsO43-���淴Ӧ���ʣ�a__(���������������)b��
��д��ͼ����c���Ӧͼ��װ�õ�������Ӧʽ______��
�����жϸ÷�Ӧ�ﵽƽ��״̬����__��
a 2v(I��)����v(AsO33-)�� b ��Һ��pH���ٱ仯
c ������ʾ����Ϊ�� d ��Һ��ɫ���ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ��������Ŷ��ˢ�����й��������Ϊ�ҹ��������Դ�Ŀ����춨�˼�ʵ�Ļ�������ͭ����Ҫ�ɷ�ΪCuReS2���Ǻ�������е�һ�֣�������ȡͭ���仯�������Ҫԭ��֮һ�������Ʊ������Ļ������ش��������⣺
��1�����������������������ѺϽ�����Ƴɣ���������7000����г���710�ֵ�����������˵����ȷ����___��
A����������������Ԫ��
B���ѺϽ�ǿ�Ȳ��Ǻܴ�
C���Ʊ������Ͻ�ʱ���ڿ����н����ֽ����ۻ����϶���
D����֪����������H2O��Ӧ�����õ�����ڶ�������ұ��������
��2�����û�ͭ��ұ��ͭ�ķ�ӦΪ8CuReS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2��CuReS2��Fe�Ļ��ϼ�Ϊ+2����Ӧ�б���ԭ��Ԫ����___������Ԫ�ط��ţ�������1molFe2O3ʱת�Ƶ��ӵ����ʵ���Ϊ___��
8Cu+4FeO+2Fe2O3+16SO2��CuReS2��Fe�Ļ��ϼ�Ϊ+2����Ӧ�б���ԭ��Ԫ����___������Ԫ�ط��ţ�������1molFe2O3ʱת�Ƶ��ӵ����ʵ���Ϊ___��
��3�����û�ͭ��ұ��ͭ������¯������Fe2O3��FeO��SiO2��Al2O3�����Ʊ�Fe2O3������Ϊ���ù���ϡ�����ȡ¯�������ˡ����Ƚ���Һ�軯���������м������NaOH��Һ�����ˣ�������ϴ�ӡ�������յ�Fe2O3����������Ϣ�ش��������⣺
a�����й��˵�Ŀ����___��������Ҫ��������___��
b����ȥA13+�Ļ�ѧ����ʽΪ___��
c�����н���Һ��������ѡ��H2O2���䷴Ӧ�����ӷ���ʽΪ___��
��4����Cu����0.1molL-1FeCl3��Һ�У���Ӧһ��ʱ���ȡ��CuƬ����Һ��c��Fe3+����c��Fe2+��=2��3����Cu2+��Fe3+�����ʵ���֮��Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������M���⽻����ҩ���ϳ�M��һ��·����ͼ��ʾ��
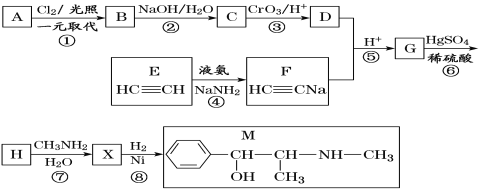
��֪��I��R��CH2OH![]() RCHO
RCHO
�ɣɣ�R1-CHO+R-C��CNa![]()
IV��
V��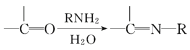
��ش��������⣺
(1)D��������_______��G�к��������ŵ�������_______��
(2)��Ӧ���ķ�Ӧ����Ϊ_______��A�Ľṹ��ʽΪ_______��
(3)д����Ӧ���Ļ�ѧ����ʽ��______________________________��
(4)X�����������_______��̼ԭ�ӹ�ƽ�档
(5)��H��ͬ���칹���У�ͬʱ�ܷ���ˮ�ⷴӦ��������Ӧ�ķ����廯�����У��˴Ź�����������4��壬�ҷ����֮��Ϊ1��1��2��6���л���Ľṹ��ʽΪ_________________��
(6)��֪��![]() �����������̣�����Ա�����ȩΪ��Ҫԭ�Ϻϳ�ijҩ���м���
�����������̣�����Ա�����ȩΪ��Ҫԭ�Ϻϳ�ijҩ���м���![]() ��·��________________��
��·��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǶԱ�������������ʶ��һ��������Ĺ��̡�
(1)��֪����ʽΪC6H6�Ľṹ�ж��֣����е�����Ϊ��
��![]() ������
������![]()
�������ֽṹ����������ڶ��Է���(����ѧ���ʷ���)������_______�������ܡ�
a�������Ը��������Һ���� b������ˮ�����ӳɷ�Ӧ
c�����巢��ȡ����Ӧ d�������������ӳɷ�Ӧ
��C6H6����������һ������ṹ(��ͼ��ʾ)���ýṹ�Ķ��ȴ�����____�֡�
![]()
(2)��Ҳ��һ�ַ����������ķ���ʽ��C10H8�������ж����Ľṹ��ʽ�����������е�____��
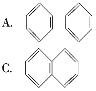
(3)���ݵ�(2)С�����жϵõ������Ľṹ��ʽ�������ܽ�������������ʵ�е�____��
A��������ʹ���Ը��������Һ��ɫ B��������H2�����ӳɷ�Ӧ
C��������������ԭ����ͬһƽ���� D��һ�����(C10H7Br)ֻ������ͬ���칹��
(4)�ִ���ѧ��Ϊ������̼̼֮��ļ���__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʹ30 g��ȩ��ȫȼ�պ�IJ���ͨ��������Na2O2��Na2O2���ص�����Ϊ (��������)
A.10 gB.15 g
C.20 gD.30 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ظ���س������л��ϳɵ��������ʹ����ȡ��ɺ�����Һ(��Ҫ��Cr3+��Fe3+��K+��SO42-��)�Ʊ�K2Cr2O7��������ͼ��ʾ��

��֪��i.�����������£�H2O2�ܽ�Cr2O72-��ԭΪCr3+��
ii.��ؽ��������γ��������������pH��Χ���£�
�������� | Fe3+ | Cr3+ |
��ʼ������pH | 1.5 | 4.9 |
������ȫ��pH | 2.8 | 6.8 |
�ش��������⣺
(1)�����ٵ���Ҫ�ɷ�Ϊ_________(�ѧʽ)��
(2)"�����������з�����Ӧ�����ӷ���ʽΪ____________��
(3)������"������Ŀ����_________��
(4)���ữ"�����з����ķ�ӦΪ2CrO42- +2H+![]() Cr2O72-+ H2O (K=4.0��1014L3��mol -3)����֪���ữ������Һ(pH=1)��c(Cr2O72- )=6. 4��10-3 mol��L-1������Һ��c(CrO42-)=_______��
Cr2O72-+ H2O (K=4.0��1014L3��mol -3)����֪���ữ������Һ(pH=1)��c(Cr2O72- )=6. 4��10-3 mol��L-1������Һ��c(CrO42-)=_______��
(5)�����������ؽ��Ƹ���ˮ�е�Cr2O72-����ԭ���乤��ԭ����ͼ��ʾ��
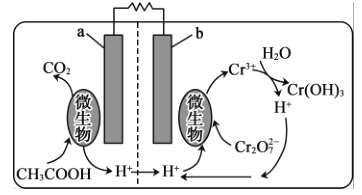
�ڸõ���У�b��______����a���ĵ缫��ӦΪ__________
(6)K2 Cr2O7����Һ�������ڲⶨ������������ƾ���(Na2S2O3��5H2O��M=248 g��mol -1)�Ĵ��ȡ��ⶨ�������£�
i.��Һ���ƣ���ȡ1.2400g������������ƾ�����Ʒ��������в���ȴ������ˮ���ձ����ܽ⣬��ȫ�ܽ��.ȫ��ת����100mL����ƿ��.������ˮ���̶��ߡ�
ii.�ζ���ȡ0.01000 mol. L-1��K2Cr2 O7����Һ20. 00 mL��ϡ�����ữ��������KI��Һ��������Ӧ(Cr2O72-����ԭ��Cr3+ ��I-��������I2)��Ȼ���������������Ʒ��Һ�ζ���������ɫ��������Ӧ��I2+2S2O32 - =S4O62-+2I-�����������Һ��Ϊָʾ���������ζ�������Һ��ɫ��ȥ.��Ϊ�յ㡣ƽ�еζ�3�Σ���Ʒ��Һ��ƽ������Ϊ25.00mL��
��ϡ�����ữ��K2Cr2O7����Һ��KI��Һ��Ӧ�����ӷ���ʽΪ_________
�ڸ�������������ƾ�����Ʒ�Ĵ���Ϊ_______%(����1λС��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ƶõ���Ȳ�г�����H2S��PH3���������塣��ͼ����ѧ����Ƶ�ʵ��װ�ã������ⶨCaC2��Ʒ�Ĵ��ȣ��ұߵķ�Ӧװ����ͬ����ߵ����巢��װ����ͬ���ֱ�����������ʾ��
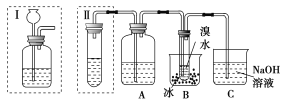
(1)Aƿ�е�Һ����Դ�����KMnO4��Һ��FeCl3��Һ��ѡ��Ӧ��ѡ��________������������___________________________��
(2)װ��������Ҫȱ����______________________________________��
(3)װ��������Ҫȱ����_____________________��
��ѡ�ô�װ�������ʵ�飬��Ӧ��ȡ�Ĵ�ʩ��___________________��
(4)����ȡa g CaC2����Ӧ��ȫ���B����ˮ����b g����CaC2�Ĵ���Ϊ________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com