
熟悉和使用中学化学实验中常见仪器及用途,是化学学习的基本要求。试回答下列问题。
(1)在仪器a.分液漏斗 b.试剂瓶 c.集气瓶 d.滴定管 e.容量瓶 f.量筒 g.托盘天平中,标有“0”刻度的是________(填序号)。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺,在下列仪器中,没有用到“磨砂”工艺处理的有________(填序号)。
a.试管 b.分液漏斗 c.带滴管的试剂瓶(滴瓶)
d.集气瓶 e.酸式滴定管 f.碱式滴定管
(3)用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集NH3或HCl气体,可供选择的液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液。试回答下列问题:

甲 乙 丙
①若制取某气体的过程中,丙中的石蕊溶液变红,且烧瓶中的试剂A与分液漏斗中的试剂B均为无色液体,则试剂A为________,制取该气体利用了B的性质有________、________。
通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满。若石蕊溶液变蓝,则烧瓶甲中应加入的固体试剂A为________。
②若在乙中收集氨气,气体流经装置的顺序是:a―→____―→_____―→d(填接口代号)。
科目:高中化学 来源: 题型:
下列说法正确的是
 ①S8 分子中 S原子采用的轨道杂化方式sp3
①S8 分子中 S原子采用的轨道杂化方式sp3
②C2H4分子中只有以s轨道与sp2杂化轨道“头碰头”方式重叠而成的σ键
③SnBr2分子中Sn—Br的键角<120°
④H3O+中H-O-H键角比H2O中H-O-H键角大
A.①② B.③④ C.①②③ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
.在高中阶段化学学科中所涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和难溶电解质溶解平衡四种,均符合勒夏特列原理,它们在工农业生产中都有广泛的应用。请回答下列问题:
Ⅰ:(1)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g) +CO2(g) CO(NH2)2 (l)+H2O(l).
CO(NH2)2 (l)+H2O(l).
① 已知该反应的平衡常数K195℃ < K165℃,则该反应的△H_______0(填“>”“=”或“<”)。
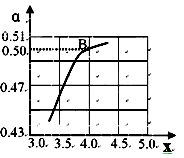
② 一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)n(NH3)/ n(CO2)=x,右图是氨碳比(x)与CO2平衡转化率(a)的关系。a随着x增大的原因是________。
③取一定量的NH3和CO2放在一个带活塞的密闭真空容器中在一定温度下反应达平衡,若在恒温、恒容
下充入气体He,CO(NH2)2(l)的质量_____(填“增加”、“减小”或“不变”)。
Ⅱ:(1)某温度下,纯水中c(H+) = 2.0×10-7mol/L,该温度下,0.9mol/L NaOH
溶液与0.1 mol/L HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的
pH=_________。
(2)向100 mL 0.10 mol/L CH3COOH的溶液中加入0.010 mol CH3COONa固体,溶
液pH增大,主要原因是(请用学过的平衡理论解释)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是立方烷的球棍模型,下列有关说法不正确的是
( )

A.其一氯代物只有一种
B.其二氯代物有三种
C.在光照下,其能与氯水发生取代反应
D.它与苯乙烯(C6H5—CH===CH2)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
实验是化学研究的基础,关于下列各实验装置图的叙述中正确的是( )
①
② ③ ④
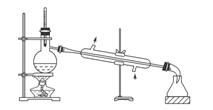
A.装置①:常用于分离互不相溶的液体混合物
B.装置②:可用于吸收NO2或HCl气体,并防止倒吸
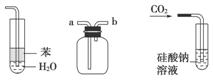
C.装置③:先从b口进气集满二氧化碳,再从a口进气,可收集一氧化氮
D.装置④:可用来证明碳的非金属性比硅强
查看答案和解析>>
科目:高中化学 来源: 题型:
图182是三种稀酸对FeCr合金随Cr的含量变化的腐蚀性实验结果,下列有关说法正确的是( )

图182
A.稀硝酸对FeCr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是Fe+6HNO3(稀)===Fe(NO3)3+3NO2↑+3H2O
C.Cr的含量大于13%时,因为三种酸中硫酸电离的氢离子的浓度最大,所以其对FeCr合金的腐蚀性最强
D.随着Cr的含量的增加,稀硝酸对FeCr合金的腐蚀性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
如何防止铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
| 序号 | 内容 |
|
| 1 | 常温下将铁丝放在干燥空气中一个月 | 干燥的铁丝表面依然光亮 |
| 2 | 常温下将铁丝放在潮湿空气中一小时 | 铁丝表面依然光亮 |
| 3 | 常温下将铁丝放在潮湿的空气中一个月 | 铁丝表面已变得灰暗 |
| 4 | 将潮湿的铁丝放在常温的氧气流中一小时 | 铁丝表面略显灰暗 |
| 5 | 将潮湿的铁丝放在高于常温的氧气流中一小时 | 铁丝表面已变得灰暗 |
| 6 | 将浸过氯化钠溶液的铁丝放在高于常温的氧气 | 铁丝表面灰暗程度比 |
下列有关说法不正确的是( )
A.上述实验中已明显发生电化学腐蚀的实验是3、4、5、6
B.影响金属腐蚀的外部因素有湿度、温度、O2的浓度、电解质等
C.实验6中铁被腐蚀的程度比5严重是因铁发生了如下反应:Fe-2e-===Fe2+
D.若保持铁表面干燥或将锌与铁相连,可 起到保护铁制品的作用
起到保护铁制品的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
已知C2H4(g)和C2H5OH(1)的燃烧热分别是1411.0kJ·mol-1和1366.8kJ mol-1,则由C2H4(g)和H2O (l)反应生成C2H5OH(l)的△H为( )
A.-44.2 kJ·mol-1 B.+44.2 kJ·mol-1
C.-330 kJ·mol-1 D.+330 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
少量铁粉与100mL 0.01 mol ·L-1的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变 H2 的产量,可以使用如下方法中的
①加H2O ②加NaOH 固体③滴入几滴浓盐酸④加CH3COONa 固体⑤加NaCl 溶液
⑥滴入几滴硫酸铜溶液⑦升高温度(不考虑盐酸挥发)⑧改用10mL 0.1 mol ·L-1盐酸
A.①⑥⑦ B.③⑤⑧ C.⑤⑥⑧ D.③⑦⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com