
【题目】下列仪器:①锥形瓶,②蒸馏烧瓶,③漏斗,④燃烧匙,⑤天平,⑥分液漏斗,⑦胶头滴管。常用于物质分离的是( )
A.①③⑤ B.②④⑦
C.①②⑥ D.②③⑥
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义。
I.污染物SO2、NOx经O2预处理后用CaSO3悬浊液吸收,可减少尾气中SO2、NOx的含量。T℃时,O2氧化烟气中SO2、NOx的主要反应的热化学方程式为:
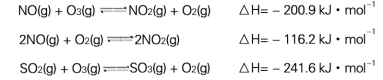
(1) T℃时,反应3NO(g)+O3(g)![]() 3NO2(g)的△H= kJ·mol-1。
3NO2(g)的△H= kJ·mol-1。
(2) T℃时,将0.6 mol NO和0.2 molO3气体充入到2L固定容积的恒温密闭容器中,NO的浓度随反应时间的变化如图1所示。
① T℃时,反应3NO(g) +O3 (g) ![]() 3NO2 (g)的平衡常数K= 。
3NO2 (g)的平衡常数K= 。
② 不能说明反应达到平衡状态的是 (填写字母)。
A.气体颜色不再改变 B.气体的平均摩尔质量不再改变
C.气体的密度不再改变 D.单位时间内生成O3和NO2物质的量之比为1∶3
II.NO2的二聚体N2O4是火箭中常用氧化剂。完成下列问题:
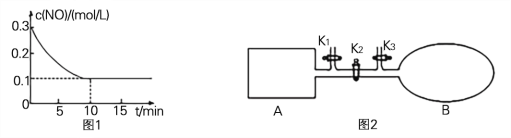
(3) 如图2所示,A是由导热材料制成的恒容密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 molNO2通过K1、K3分别充入真空A、B中,反应起始时A、B的体积相同均为aL(忽略导管中的气体体积)。
① 容器A中到达平衡所需时间ts,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)= 。
② 平衡后在A容器中再充入0.5 mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数(填“变大”、“变小”或“不变”) 。
③ 在②平衡后,打开K2,重新到达新平衡,B气囊的体积为0.8aL,则在打开K2之前,气囊B的体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人们的生活、健康密切相关.下列做法不合理的是( )
A. 用米汤检验加碘食盐中的碘酸钾(KIO3)
B. 向豆浆中加入盐卤(主要成分为MgCl2)制做豆腐
C. 用灼烧和闻气味的方法区别棉织物和纯毛织物
D. 向污水中加入适量明矾,可除去其中的悬浮物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如图(废料中含有Al、Li、Co2O3和Fe2O3等物质).

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表.
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | ﹣0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式: 。
(2)步骤Ⅲ中 Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过 ;废渣中的主要成分除了LiF外,还有 。
(3)NaF 与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是 。
(4)在空气中加热5.49g草酸钴晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.已知:M(CoC2O4·2H2O)=183g/mol
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
890~920 | 2.25 |
经测定,210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是 。温度高于890℃时,固体产物发生分解反应,固体产物为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同物质的量的O2和O3的质量比为_________;所含氧原子的个数比为______________。
(2)2.5 mol Ba(OH)2中含有_________个OH—,2.5 mol Ba(OH)2的质量是____________g。
(3)在标准状况下,1.7 g氨气所占的体积约为__________L,它与标准状况________L硫化氢含有相同数目的氢原子。
(4)某气态氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为________________。
(5)同温同压下,SO2与氦气的密度之比为________,若质量相同,两种气体的体积比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是周期表中短周期的一部分,已知A、C两种元素的核电荷数之和等于B的核电荷数,下列叙述正确的是( )
A | C | |
B |
A.B为第二周期的元素
B.C为第五主族元素
C.A的原子序数为6
D.C是非金属性最强的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在; 钴以Co2O3 ·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下:

(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴.则浸出钴的离子反应方程式为(产物中只有一种酸根) 。在实验室模拟工业生产时,也可用盐酸代替酸化的Na2S2O3,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因 。
(3)用离子方程式表示过程III和IV中Na2CO3的主要作用 。
(4)CoO溶于盐酸可得粉红色的CoCl2溶液.CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2 吸水变色这一性质可制成变色水泥和显隐墨水.图2是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是 .

(5)某天然碱的化学式可表示为2Na2CO3·NaHCO3·2H2O,取少量该物质溶于水得稀溶液。下列有关该溶液中微粒的物质的量浓度关系正确的是 (填序号)。
A.c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C.3c(Na+)>5c(CO32-)+5c(HCO3-)
D.将该溶液与少量NaOH溶液混合:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com