
【题目】下列各组物质中,都是共价化合物的是( )
A、H2S和Na2O2 B、H2O2和CaF2 C、NH3和N2 D、HNO3和HClO3
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
下列说法正确的是
A. 加入CH3OH的物质的量a=1.64
B. 此时刻正反应速率大于逆反应速率
C. 若起始时加入2a mol CH3OH,则达到平衡时CH3OH的转化率减小
D. 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,按要求填空(填元素符号或化学式):
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
4 | ⑧ | ⑨ | ⑩ |
(1)写出下列元素的元素符号:① _____ ②_____ ⑩_____
(2)在这些元素中,最活泼的金属元素是_____,最不活泼的元素是_____。
(3)这些元素的最高价氧化物对应水化物中,具有两性的是__________,它在水中的电离方程式为______________________________________________/span>
(4)将元素⑤、⑨和⑩的简单离子按半径由大到小排序____________________
(5)在③与④的单质中,化学性质较活泼的是____,写出一个可以验证该结论的化学事实______________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】升高温度能使反应速率加快,下列叙述正确的是( )
A. 降低反应所需的活化能
B. 使反应体系的活化分子百分数增大
C. 体系中活化分子总数不变
D. 对于吸热反应、放热反应,反应速率同等程度加大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由14CO和12CO组成的混合气体与同温同压下空气的密度相等(空气的平均相对分子质量为29),则下列关系正确的是
A. 混合气体中,12CO占有的体积等于14CO占有的体积
B. 混合气体中,12CO与14CO分子个数之比为1∶2
C. 混合气体中,12CO与14CO质量之比为15∶14
D. 混合气体中,12CO与14CO密度之比为14∶15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液氨—液氧燃料电池曾用于驱动潜艇,其示意图如图所示。
(1)该电池的总反应式为_____________,电极1发生的电极反应为__________;
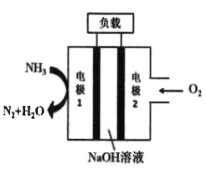
(2)下列说法正确的是______________;
A. 电极2是正极,发生还原反应
B. 电池工作时,Na+向电极1移动
C. 电流由电极2经外电路流向电极1
D. 该装置将化学能转化为电能再转化为机械能
(3)当电路中通过的电子数为0.4mol时,理论上需消耗标准状况下氧气的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
B. 1mol碳化硅晶体中,平均含有4mol C—Si共价键
C. 水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键
D. 某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE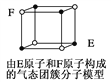
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表中前四周期的部分元素,表中所列的字母分别代表一种化学元素,根据要求回答下列各小题:
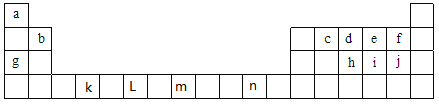
(1)①元素非金属性强弱比较有很多方法,其中f和j的非金属性强弱的研究方案中不可行的是_________(填序号)
a.比较两种单质的颜色 b.比较氢化物的稳定性 c.依据两元素在周期表的位置
d.比较电负性 e.比较最高价氧化物对应水合物的酸性
②根据元素原子的外围电子排布的特征,可将元素周期表前四周期元素分成4个区域,分别为s区、p区、d区、ds区,则属于s区的元素有_______种,属于d区的元素有_______种;元素n属于________区。
③在c、d、e三种元素中,电负性由小到大的顺序是______________,第一电离能由大到小的顺序是____________(用元素符号回答)。
(2)①写出 n2+的核外电子排布式:______________________。
②写出k元素基态原子的价电子排布式:_____________。
③写出 L元素基态原子的外围电子排布式:_____________。
④写出m元素基态原子价电子的轨道表示式:________________________,该元素在元素周期表中的位置为:__________________________。
⑤j简单阴离子的结构示意图为____________。
(3)①元素i的氢化物分子属于____________(填“极性”或“非极性”)分子,其分子的空间构型为____________,该氢化物分子中i原子轨道的杂化类型是__________; 由i与e形成的ie42-离子,其空间构型为__________(用文字描述)。
②已知cd- 与 d2 结构相似,1 mol cd- 中![]() 键数目为___________,由d形成的离子d3-与CO2互为等电子体,则d3-的分子构型为___________。
键数目为___________,由d形成的离子d3-与CO2互为等电子体,则d3-的分子构型为___________。
③f2通入稀NaOH溶液中可生成Of2,Of2分子构型为___________,其中氧原子的杂化方式为_______;
④化合物j2e的立体构型为_________,中心原子的价层电子对数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是( )

A. 所含原子数相等 B. 气体密度相等C.气体质量相等 D.摩尔质量相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com