
【题目】利用废旧镀锌铁皮(含Fe、Zn、Fe2O3、ZnO)制备纳米Fe3O4及副产物ZnO的流程如下:
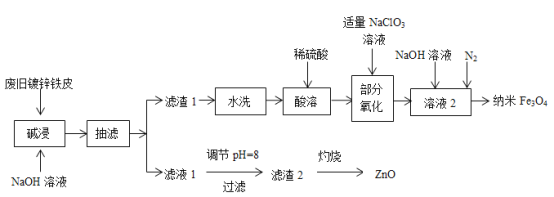
已知:Zn及其化合物的性质与Al及其化合物的性质相似,“滤液1”中锌元素以ZnO22-形式存在。回答下列问题:
(1)实验中需调节“滤液1”的pH约为8,pH过大或过小都不利的原因是_______________。
(2)“滤渣1”的主要成分是__________(填化学式,下同),“滤渣2”的主要成分是_______。
(3)“部分氧化”阶段,ClO3-被还原为Cl-,该反应的离子方程式是____________________。
(4)向“溶液2”中通入N2的目的是________________________________________________。
(5)某化学兴趣小组用m1 g废旧镀锌铁皮(Fe元素的质量分数为w)制备纳米Fe3O4,最终得到m2 g产品,则产率为__________(用含m1、m2和w的代数式表示)。
(6)用酸性高锰酸钾溶液可测定产物Fe3O4中二价铁含量,用稀硫酸溶解Fe3O4,再用酸性KMnO4标准溶液进行滴定,发生反应:5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O。
①判断该反应到达滴定终点的现象是______________________________________________。
②滴定操作中,若滴定前装有酸性KMnO4标准溶液的滴定管尖嘴部分无气泡,而滴定结束后有气泡,则测得的二价铁含量__________(填“偏高”偏低”或“无影响”)。
【答案】pH过小,导致氢氧化锌沉淀溶解;pH过大,ZnO22-不会完全转化为Zn(OH)2,ZnO的产率减小 Fe、Fe2O3 Zn(OH)2 6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O 防止Fe2+被氧化 ![]() 当滴入最后一滴KMnO4溶液时,溶液由淡黄色变成浅红色,且半分钟内不褪色 偏低
当滴入最后一滴KMnO4溶液时,溶液由淡黄色变成浅红色,且半分钟内不褪色 偏低
【解析】
由流程图可知,废旧镀锌铁皮(含Fe、Zn、Fe2O3、ZnO)加NaOH后,Zn、ZnO转化为ZnO22-,进入滤液1中,Fe2O3、Fe不与NaOH反应,进入到滤渣1中。滤渣1经水洗、酸溶,转化为含有Fe2+和Fe3+的溶液,加入NaClO3氧化,使部分Fe2+转化为Fe3+,再加入NaOH,在N2的保护下使Fe2+和Fe3+转化为纳米Fe3O4。滤液调pH后ZnO22-转化为Zn(OH)2沉淀下来,滤渣2即为Zn(OH)2,经灼烧后转化为ZnO。
(1)根据分析,滤液1中为ZnO22-,pH过小,会导致Zn(OH)2沉淀溶解:Zn(OH)2+2H+=Zn2++2H2O;由于ZnO22-在强碱中可稳定存在,pH过大,ZnO22-不会完全转化为Zn(OH)2,最终生成的ZnO减少;
(2)由分析可知,滤渣1的主要成分是Fe、Fe2O3,滤渣2的主要成分是Zn(OH)2;
(3)部分氧化过程中,Fe2+被氧化为Fe3+,根据题意,ClO3-被还原为Cl-,故离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O;
(4)由于部分氧化之后,溶液中的Fe2+和Fe3+已经符合纳米Fe3O4要求的比例,而在加NaOH的过程中,Fe2+易被氧化,故通N2的目的是防止Fe2+被氧化;
(5)Fe3O4中Fe占的比例为![]() ,m1 g废旧镀锌铁皮(Fe元素的质量分数为w)理论上能产生Fe3O4的质量为
,m1 g废旧镀锌铁皮(Fe元素的质量分数为w)理论上能产生Fe3O4的质量为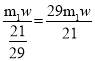 ,最终得到m2 g产品,则产率为
,最终得到m2 g产品,则产率为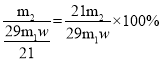 ;
;
(6)①用酸性KMnO4溶液可测定产物Fe3O4中的Fe2+,由于原溶液中既有Fe2+又有Fe3+,故原溶液为黄色,当Fe2+被滴定完后,溶液中出现KMnO4,溶液变为浅红色,所以滴定终点现象为:当滴入最后一滴KMnO4溶液时,溶液由淡黄色变成浅红色,且半分钟内不褪色。
②若滴定前装有酸性KMnO4标准溶液的滴定管尖嘴部分无气泡,而滴定结束后有气泡,说明滴定使用的KMnO4标准溶液体积偏小,导致计算时算出的Fe2+含量也偏小。


科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、 Y、Z三种气体的物质的量随时间变化的曲线如图所示:

下列描述正确的是( )
A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)-1
B. 反应开始到l0s,X的物质的量浓度减少了0.79mol/L
C. 反应开始到10s时,Y的转化率为79.0%
D. 反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属A能够被磁铁所吸引.A及其A的化合物之间有如下的转化关系:
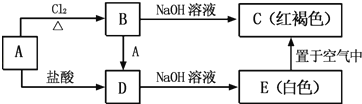
(1)写出A、C的化学式:A_____;C_____.
(2)检验B中阳离子的试剂是_____.
(3)写出下列反应的化学方程式或离子方程式:
A→D 的离子方程式_____
E→C 的化学方程式_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积的关系如图所示(不考虑CO2在水中的溶解)。
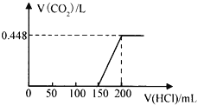
(1)写出 0~150mL 段发生反应的离子方程式为:____________;150mL ~200mL段发生反应的离子方程式为:___________________;
(2)所用盐酸的物质的量浓度为_______________;
(3)将上述氢氧化钠固体样品溶于水,所形成溶液的溶质为___________、_________(写化学式),其物质的量分别为 ____________、_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温密闭容器中发生反应:CaCO3(s)![]() CaO(s)+CO2(g) H>0,反应达到平衡后,tl时缩小容器体积, x随时间(t)变化的关系如下图所示。x不可能是( )
CaO(s)+CO2(g) H>0,反应达到平衡后,tl时缩小容器体积, x随时间(t)变化的关系如下图所示。x不可能是( )
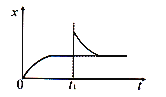
A. υ逆(逆反应速率)B. ρ(容器内气体密度)
C. m(容器内CaO质量)D. p(容器压强)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,H2S的Ka1=1.0×10-7,Ka2=7.0×10-15。下列说法正确的是
A.0.1 mol·L-1的NaHS溶液中:c(S2-)>c(H2S)
B.反应S2-+H2O![]() HS-+OH-的平衡常数K=1×10-7
HS-+OH-的平衡常数K=1×10-7
C.0.1 mol·L-1的Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S)
D.NaHS与Na2S以任意比混合的溶液中:c(Na+)+c(H+)=c(HS-)+c(S2-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.50 g 34%H2O2溶液中含H-O键的数目为NA
B.180 g淀粉完全水解生成葡萄糖的分子数为NA
C.1 L 0.1 mol·L-1K2SiO3溶液中含SiO32-的数目为0.1NA
D.反应5NaClO2+4HCl=4ClO2↑+5NaCl+2H2O,每生成1 mol ClO2转移电子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,科学家成功研制出一种电源,该电源在消耗二氧化碳的同时,还可释放电能。电源电极为铝电极和多孔碳电极,电解质溶液为草酸盐溶液,放电过程中草酸盐浓度基本不变,电源示意图如图所示。下列有关该电源的说法正确的是
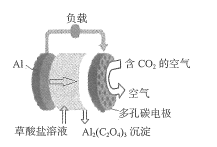
A.铝电极电势高于多孔碳电极
B.用该电源电解饱和食盐水,理论上,每消耗1mol二氧化碳可收集到标准状况下 11.2L 氢气
C.若生成0.5 mol 草酸铝,有3mol电子通过电解质溶液
D.正极的电极反应式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,W、Y同主族,Y是地壳中含量最多的金属元素,Z原子最外层电子数是其内层电子数的![]() 。若自然界存在游离态的X,则下列说法正确的是
。若自然界存在游离态的X,则下列说法正确的是
A.元素非金属性的顺序为W>X>ZB.X的氢化物分子中可能含有非极性键
C.工业上通常采用热分解法冶炼Y的单质D.Z的最高价氧化物的水化物属于强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com