
【题目】室温时,H2S的Ka1=1.0×10-7,Ka2=7.0×10-15。下列说法正确的是
A.0.1 mol·L-1的NaHS溶液中:c(S2-)>c(H2S)
B.反应S2-+H2O![]() HS-+OH-的平衡常数K=1×10-7
HS-+OH-的平衡常数K=1×10-7
C.0.1 mol·L-1的Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S)
D.NaHS与Na2S以任意比混合的溶液中:c(Na+)+c(H+)=c(HS-)+c(S2-)+c(OH-)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.用浓盐酸分别和MnO2、KClO3反应制备1 mol氯气,转移的电子数均为2NA
B.0.1 mol·L-1 NaF溶液中所含F-的数目小于0.1NA
C.用1 L 1 mol·L-1 FeCl3溶液充分反应制备氢氧化铁胶体,该体系中含氢氧化铁胶体粒子数目为1NA
D.标准状况下,4.48 L CO2和N2O的混合气体中含有的电子数为4.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为达到实验目的,下列选用的装置、实验操作均正确的是
实验目的 | 实验步骤和装置 | |
A | 比较H2O2和Fe3+的氧化性 | 将盐酸酸化的双氧水滴入Fe(NO3)2溶液中 |
B | 配制100 mL 1.0 mol·L-1NaOH溶液 | 向100mL容量瓶中加入4.0 g NaOH固体,加水到刻度线 |
C | 验证牺牲阳极的阴极保护法 |
往铁电极附近滴加铁氰化钾溶液 |
D | 探究温度对反应速率的影响 | 将两片大小相同的淀粉碘化钾试纸分别放置于两支规格相同的试管中,向试纸上滴加2.0 mol·L-1的H2SO4溶液2~3滴,密封试管,分别在室温和40℃水浴中反应,观察并记录变色时间 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾是一种高效多功能的新型非氯绿色消毒剂,主要用于饮水处理。实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
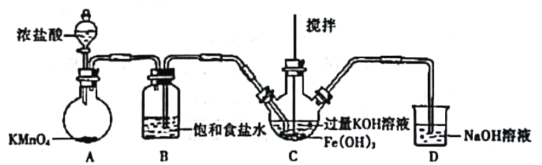
①如图所示,A为氯气发生装置。装置A、B、C、D中存在错误的是______________(填序号)。
②C中得到紫色固体和溶液。C中通入氯气发生反应,生成高铁酸钾(K2FeO4)的化学方程式为_______,此外Cl2还可能与过量的KOH反应。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4,氧化了Cl-而产生Cl2,设计以下方案:
方案I | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。 |
方案II | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
i.由方案I中溶液变红可知溶液a中含有__________离子,但该离子的存在不能判断一定是K2FeO4,氧化了Cl2,因为K2FeO4,在酸性溶液中不稳定,请写出K2FeO4在酸性溶液中发生反应的离子方程式___________________________________。
ii.方案Ⅱ可证明K2FeO4,氧化了Cl-.用KOH溶液洗涤的目的是_______________。
②根据K2FeO4的制备实验得出:氧化性Cl2_____FeO42- (填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系恰好相反,原因是_______________。
(3)若在制备装置C中加入Fe(OH)3的质量为14.0g,充分反应后经过滤、洗涤、干燥得K2FeO4固体19.3g,则K2FeO4的产率为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮(含Fe、Zn、Fe2O3、ZnO)制备纳米Fe3O4及副产物ZnO的流程如下:
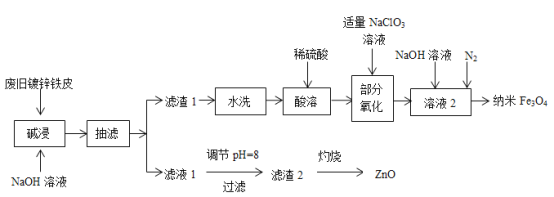
已知:Zn及其化合物的性质与Al及其化合物的性质相似,“滤液1”中锌元素以ZnO22-形式存在。回答下列问题:
(1)实验中需调节“滤液1”的pH约为8,pH过大或过小都不利的原因是_______________。
(2)“滤渣1”的主要成分是__________(填化学式,下同),“滤渣2”的主要成分是_______。
(3)“部分氧化”阶段,ClO3-被还原为Cl-,该反应的离子方程式是____________________。
(4)向“溶液2”中通入N2的目的是________________________________________________。
(5)某化学兴趣小组用m1 g废旧镀锌铁皮(Fe元素的质量分数为w)制备纳米Fe3O4,最终得到m2 g产品,则产率为__________(用含m1、m2和w的代数式表示)。
(6)用酸性高锰酸钾溶液可测定产物Fe3O4中二价铁含量,用稀硫酸溶解Fe3O4,再用酸性KMnO4标准溶液进行滴定,发生反应:5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O。
①判断该反应到达滴定终点的现象是______________________________________________。
②滴定操作中,若滴定前装有酸性KMnO4标准溶液的滴定管尖嘴部分无气泡,而滴定结束后有气泡,则测得的二价铁含量__________(填“偏高”偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值,下列有关叙述正确的是( )
A.将78Na2O2与过量H2O反应转移的电子数为NA
B.2molSO2与1molO2反应生成的SO3分子数为2NA
C.标准状况下,2.24L SO3中所含原子数为0.4NA
D.1molCl2参加反应转移电子数一定为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘.为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(苯,一种不溶于水,密度比水小的液体):
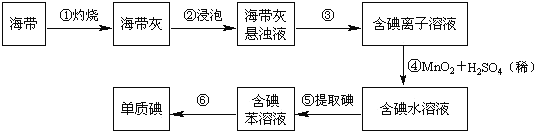
请填写下列空白:(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是(从下列仪器中选出所需的仪器,用标号字母填写在空白处)___________.
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_________;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是_________.
(3)步骤⑤是萃取、分液,某学生选择用苯来提取碘的理由是________________________.
(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法是:____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下图所示实验的预测现象不正确的是
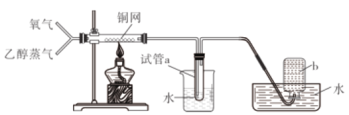
选项 | 操作 | 预测现象 |
A | 通入一段时间的氧气后点燃酒精灯 | 铜网会逐渐变黑 |
B | 通入氧气并加热一段时间后通入乙醇蒸气 | 铜网将逐渐变成红色 |
C | 预先通入氧气排净装置中的空气后再进行实验 | 集气瓶b中不会收集到气体 |
D | 观察试管a中收集到的溶液 | 溶液无色有刺激性气味 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com