
【题目】有关下图所示实验的预测现象不正确的是
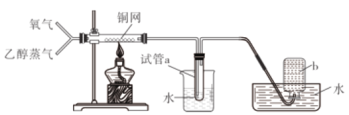
选项 | 操作 | 预测现象 |
A | 通入一段时间的氧气后点燃酒精灯 | 铜网会逐渐变黑 |
B | 通入氧气并加热一段时间后通入乙醇蒸气 | 铜网将逐渐变成红色 |
C | 预先通入氧气排净装置中的空气后再进行实验 | 集气瓶b中不会收集到气体 |
D | 观察试管a中收集到的溶液 | 溶液无色有刺激性气味 |
A.AB.BC.CD.D
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】室温时,H2S的Ka1=1.0×10-7,Ka2=7.0×10-15。下列说法正确的是
A.0.1 mol·L-1的NaHS溶液中:c(S2-)>c(H2S)
B.反应S2-+H2O![]() HS-+OH-的平衡常数K=1×10-7
HS-+OH-的平衡常数K=1×10-7
C.0.1 mol·L-1的Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S)
D.NaHS与Na2S以任意比混合的溶液中:c(Na+)+c(H+)=c(HS-)+c(S2-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某干燥粉末可能由![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的一种或几种组成。将该粉末与足量的盐酸反应有气体
中的一种或几种组成。将该粉末与足量的盐酸反应有气体![]() 逸出,
逸出,![]() 通过足量的
通过足量的![]() 溶液后体积缩小(同温、同压下测定)。若将原来混合粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合粉末的质量。下列判断正确的是
溶液后体积缩小(同温、同压下测定)。若将原来混合粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合粉末的质量。下列判断正确的是
①粉末中一定有![]() 、
、![]() 、
、![]() , ②粉末中一定不含
, ②粉末中一定不含![]() 和
和![]()
③粉末中一定不含有![]() 和
和![]() ④无法肯定粉末中是否含有
④无法肯定粉末中是否含有![]() 和
和![]()
A.①④B.②③C.③④D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室进行氨溶于水的喷泉实验装置,下列叙述不正确的是( )
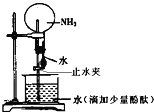
A.该实验说明氨气是一种极易溶于水的气体
B.进入圆底烧瓶中的液体颜色由无色变为红色,说明氨水呈碱性
C.形成喷泉的原因是氨气溶于水后,圆底烧瓶内的气压小于外界大气压
D.用氢气代替氨气,利用此装置也可进行喷泉实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,W、Y同主族,Y是地壳中含量最多的金属元素,Z原子最外层电子数是其内层电子数的![]() 。若自然界存在游离态的X,则下列说法正确的是
。若自然界存在游离态的X,则下列说法正确的是
A.元素非金属性的顺序为W>X>ZB.X的氢化物分子中可能含有非极性键
C.工业上通常采用热分解法冶炼Y的单质D.Z的最高价氧化物的水化物属于强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25° C时,二元酸H2X的电离平衡常数K1=5.0×10-2,K2=5.4×10-5。此温度下用AgNO3溶液分别滴定浓度均为0.01mol·L-1的KY和K2X溶液,所得的沉淀(AgY和Ag2X)溶解平衡图像如图所示。下列叙述正确的是
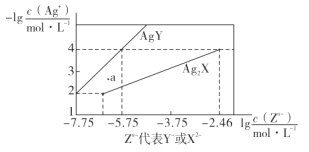
A.25°C时,KHX的溶液pH>7
B.反应Ag2X+2Y- 2AgY+ X2-的平衡常数为103.29
C.a点既可以表示AgY的不饱和溶液也可以表示Ag2X的过饱和溶液
D.向c(Y-)=c(X2-)=0.01 mol·L-1的混合液中滴入AgNO3溶液时,先生成AgY沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在做实验时引发了镁失火,他立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧发生以下反应:2Mg+CO2![]() 2MgO+C,下列关于该反应的判断正确的是
2MgO+C,下列关于该反应的判断正确的是
A. Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B. 由此反应可以判断氧化性CO2>MgO,还原性Mg>C
C. CO2作氧化剂,表现氧化性,发生氧化反应
D. Mg原子失去的电子数目等于O原子得到的电子数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,下列各组热化学方程式中,△H2>△H1的是
A.2H2(g)+O2(g)=2H2O(g) ΔH1;2H2(g)+O2(g)=2H2O(l) ΔH2
B.S(s)+O2(g)=SO2(g) ΔH1; S(g)+O2(g)=SO2(g) ΔH2
C.![]() ΔH1;C(s)+O2(g)=CO2(g) ΔH2
ΔH1;C(s)+O2(g)=CO2(g) ΔH2
D.H2(g)+Cl2(g)=2HCl(g) ΔH1; ![]() ΔH2
ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)汽车尾气中的 NO和CO可在催化剂作用下生成无污染的气体而除去。在密闭容器中充入10 mol CO和8 mol NO发生反应,测得平衡时NO的体积分数与温度、压强的关系如图。
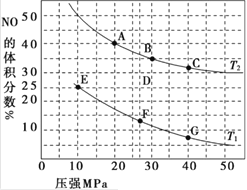
①已知该反应在较低温度下能自发进行,则反应 2NO(g)+2CO(g)![]() N2(g)+2CO2 (g),ΔH______0(填“>” “=”或“<”)。
N2(g)+2CO2 (g),ΔH______0(填“>” “=”或“<”)。
②该反应达到平衡后,为同时提高反应速率和CO的转化率,可采取的措施有______ (填字母序号)
a.改用高效催化剂 b.缩小容器的体积 c.增加 NO 的浓度 d.升高温度
(2)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2,将一定比例的O2、NH3 和NOx的混合气体匀速通入装有催化剂M的反应器中反应,反应相同时间,NOx的去除率随反应温度的变化曲线如图所示。
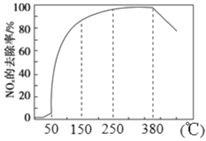
解释在50 ℃~150 ℃范围内随温度升高,NOx 的去除率迅速上升的原因是_______
(3)NH3催化还原氮氧化物技术是目前应用最广泛的烟气脱氮技术:4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(g) ΔH<0。密闭容器中,在相同时间内,在催化剂 A作用下脱氮率随温度变化如图所示。
5N2(g)+6H2O(g) ΔH<0。密闭容器中,在相同时间内,在催化剂 A作用下脱氮率随温度变化如图所示。
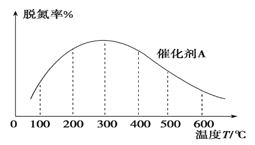
现改用催化能力稍弱的催化剂B进行实验,请在上图中画出在催化剂 B作用下的脱氮率随温度变化的曲线_________(不考虑温度对催化剂活性的影响)。
(4)某研究小组利用反应:C(s)+2NO(g)![]() N2(g)+CO2(g) △ H= -34.0 kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得 NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) △ H= -34.0 kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得 NO的转化率随温度的变化如图所示:
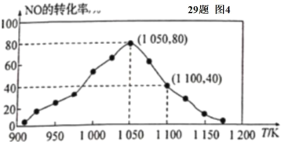
①由图可知,在 1050 K 前,反应中 NO的转化率随温度升髙而增大,其原因为____________; 在 1100 K 时,N2的体积分数为____________。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作 Kp )。在 1050 K、1.1×106 Pa 时,该反应的化学平衡常数 Kp=____________(已知:气体分压(P分) =气体总压(Pa)×体积分数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com