
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,W、Y同主族,Y是地壳中含量最多的金属元素,Z原子最外层电子数是其内层电子数的![]() 。若自然界存在游离态的X,则下列说法正确的是
。若自然界存在游离态的X,则下列说法正确的是
A.元素非金属性的顺序为W>X>ZB.X的氢化物分子中可能含有非极性键
C.工业上通常采用热分解法冶炼Y的单质D.Z的最高价氧化物的水化物属于强酸
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮(含Fe、Zn、Fe2O3、ZnO)制备纳米Fe3O4及副产物ZnO的流程如下:
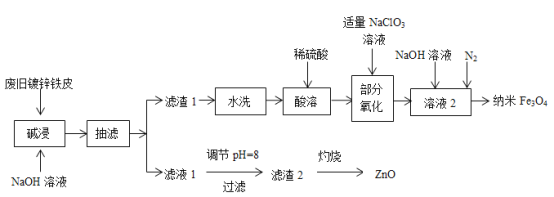
已知:Zn及其化合物的性质与Al及其化合物的性质相似,“滤液1”中锌元素以ZnO22-形式存在。回答下列问题:
(1)实验中需调节“滤液1”的pH约为8,pH过大或过小都不利的原因是_______________。
(2)“滤渣1”的主要成分是__________(填化学式,下同),“滤渣2”的主要成分是_______。
(3)“部分氧化”阶段,ClO3-被还原为Cl-,该反应的离子方程式是____________________。
(4)向“溶液2”中通入N2的目的是________________________________________________。
(5)某化学兴趣小组用m1 g废旧镀锌铁皮(Fe元素的质量分数为w)制备纳米Fe3O4,最终得到m2 g产品,则产率为__________(用含m1、m2和w的代数式表示)。
(6)用酸性高锰酸钾溶液可测定产物Fe3O4中二价铁含量,用稀硫酸溶解Fe3O4,再用酸性KMnO4标准溶液进行滴定,发生反应:5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O。
①判断该反应到达滴定终点的现象是______________________________________________。
②滴定操作中,若滴定前装有酸性KMnO4标准溶液的滴定管尖嘴部分无气泡,而滴定结束后有气泡,则测得的二价铁含量__________(填“偏高”偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,下列对该溶液成分说法不正确的是( )
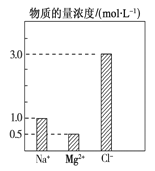
A. NaCl的物质的量为0.1mol
B. 该混合液中BaCl2的物质的量为0.05mol
C. 溶质MgCl2的质量为9.5 g
D. 将该混合液加水稀释至体积为1 L,稀释后溶液中的Na+物质的量的浓度为0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)的几种化合物存在下列转化关系:

已知:2CrO42-+2H+![]() Cr2O72-+H2O。下列判断不正确的是( )
Cr2O72-+H2O。下列判断不正确的是( )
A.反应①表明Cr2O3有酸性氧化物的性质
B.反应②利用了H2O2的氧化性
C.反应③中溶液颜色变化是由化学平衡移动引起的
D.反应①②③中铬元素的化合价均发生了变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水中含有多种成分,因而具有多种性质,根据氯水分别与右图中四种物质发生的反应 (a、b、c、d重合部分代表物质间可反应,且氯水足量)。能证明氯水具有漂白性的是( )

A.aB.bC.cD.d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下图所示实验的预测现象不正确的是
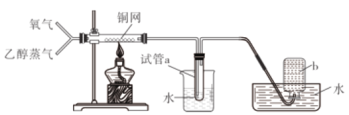
选项 | 操作 | 预测现象 |
A | 通入一段时间的氧气后点燃酒精灯 | 铜网会逐渐变黑 |
B | 通入氧气并加热一段时间后通入乙醇蒸气 | 铜网将逐渐变成红色 |
C | 预先通入氧气排净装置中的空气后再进行实验 | 集气瓶b中不会收集到气体 |
D | 观察试管a中收集到的溶液 | 溶液无色有刺激性气味 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中共十九大报告指出,加快水污染防治、实施流域环境和近岸海域综合治理、环境污染的治理是化学工作者研究的重要课题,也是践行“绿水青山就是金山银山”的重要举措。在适当的条件下,将CO2转化为甲醇、甲醚等有机物,既可降低CO2造成的温室效应对环境的影响,还可得到重要的有机产物。
(1)已知:①2H2(g)+O2(g)=2H2O(g) ΔH1=484 kJ/mol
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2=50 kJ/mol
CH3OH(g)+H2O(g) ΔH2=50 kJ/mol
则2CH3OH(g)+3O2(g)= 2CO2(g)+4H2O(g) ΔH,ΔH=____。
(2)已知T K时,某恒容密闭容器中存在如下反应:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如表所示:
CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如表所示:
c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | |
开始时 | a | b | 0 | 0 |
10 s时 | 3 | 0.5 | c | 1.5 |
①若反应开始到10s时间段内,v(H2)=____。
②若TK时,化学平衡常数K=15,则10s时v(正)___v(逆)(填“>”“<”或“=”),此时CO2的转化率为____。
(3)一定条件下,向某恒容密闭容器中充入x mol CO2和ymolH2,发生的反应为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。图1中能表示该反应的平衡常数K与温度T之间的变化关系曲线为___(填“a”或“b”)。
CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。图1中能表示该反应的平衡常数K与温度T之间的变化关系曲线为___(填“a”或“b”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示渗透作用装置图,其中半透膜为膀胱膜,甲、丙装置中A、B、a、b溶液浓度分别用MA、MB、Ma、Mb表示,乙、丁装置分别表示一段时间后甲、丙装置的状态,液面上升的高度分别为h1、h2。如果A、B、a、b均为蔗糖溶液,且MA>MB,Ma=Mb>MA,则达到平衡后( )
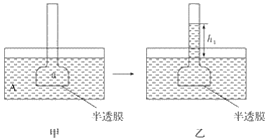
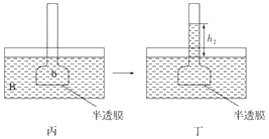
A. h1>h2、Ma>MbB. h1>h2、Ma<Mb
C. h1<h2、Ma<MbD. h1<h2、Ma>Mb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L恒容密闭容器中充入![]() 、
、![]() ,在一定条件下发生如下反应:
,在一定条件下发生如下反应:![]()
![]() ;CO的平衡转化率与温度、压强之间的关系如图所示。下列推断正确的是( )
;CO的平衡转化率与温度、压强之间的关系如图所示。下列推断正确的是( )
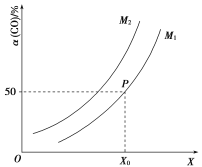
A.工业上,利用上述反应合成甲醇,温度越高越好
B.图象中X代表温度,![]()
C.图象中P点代表的平衡常数K为![]()
D.温度和容积不变,再充入![]() 、1 mol CO,达到平衡时CO的转化率减小
、1 mol CO,达到平衡时CO的转化率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com