
【题目】从酸性蚀刻废液(含FeCl2、CuCl2、HCl及少量FeCl3)中回收铜并再生FeCl3酸性溶液的过程中,不涉及的操作是
A.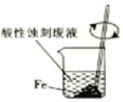 B.
B.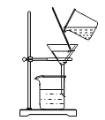
C.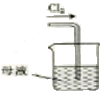 D.
D.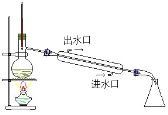
【答案】D
【解析】
从酸性蚀刻废液(含FeCl2、CuCl2、HCl及少量FeCl3)中回收铜并再生FeCl3酸性溶液的过程为:先在溶液中加过量的Fe,使FeCl3和HCl都转化为FeCl2,并将CuCl2中的Cu置换出来,再过滤,将固体Cu和过量的Fe分离出来,之后可用磁铁将混合物分离,得到Cu单质。滤液中主要剩余FeCl2,通入Cl2,将FeCl2氧化为FeCl3,达到再生FeCl3的目的。
A.根据分析,酸性蚀刻废液中需先加Fe搅拌,A正确;
B.酸性蚀刻废液与Fe反应完后要过滤,B正确;
C.滤液需用Cl2氧化为FeCl3,C正确;
D.根据分析,整个操作过程不需要蒸馏操作,D错误;
故选D。


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:
【题目】现有三种可溶性物质A、B、C,其中有一种是碱,两种是盐,溶于水后电离产生的离子如下表所示:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
为鉴别它们,分别完成一些实验。请根据实验的结果回答下列问题:
(1)A溶液与B溶液反应可生成气体X。根据上述六种离子之间的可能反应判断X的化学式为 ,A溶液与B溶液反应的离子方程式为 。
(2)气体X可以和C溶液反应生成沉淀D,沉淀D可与B溶液反应。则C的化学式为 ,B溶于水后的电离方程式为 。
(3)B溶液与C溶液反应生成不溶于稀硝酸的白色沉淀E。B溶液与C溶液反应至中性的离子方程式为 。
(4)D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为bL,则求算E在混合物中的质量分数的表达式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84 g/cm3 )配制100 mL l mol/L的稀硫酸。现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,按使用仪器的先后顺序排列正确的是.( )
A.④③⑦⑤⑥;B.②⑤⑦⑥;C.①③⑤⑥⑦;D.②⑥③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗癌药托瑞米芬的前体J的合成路线如下。
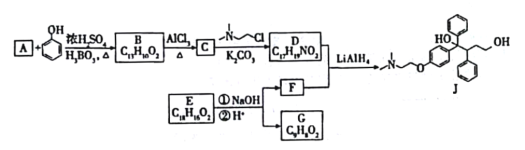
已知:
i.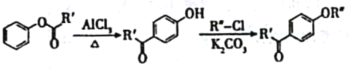
ii.有机物结构可用键线式表示,如(CH3)2NCH2CH3的键线式为![]()
(1)有机物A能与Na2CO3溶液反应产生CO2,其钠盐可用于食品防腐,其名称为_______________.
(2)C中含有的官能团为______________________________(填名称)。
(3)C→D的化学反应方程式为_________________________,反应类型为______________________。
(4)E是一种天然香料,经碱性水解、酸化,得F和G。G经还原可转化为F。G的结构简式为________________________________。
(5)K是G的同分异构体,符合下列条件的K的结构简式是_____________________。(任意写一种)
①包含2个六元环
②K可水解,与NaOH溶液供热时,1molK消耗1molNaOH
(6)推测D和F反应得到J的过程中,反应物LiAIH4的作用是_________________。
(7)由J合成托瑞米芬的古城:
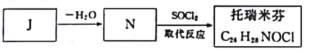
托瑞米芬具有反应结构,其结构简式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,H2S的Ka1=1.0×10-7,Ka2=7.0×10-15。下列说法正确的是
A.0.1 mol·L-1的NaHS溶液中:c(S2-)>c(H2S)
B.反应S2-+H2O![]() HS-+OH-的平衡常数K=1×10-7
HS-+OH-的平衡常数K=1×10-7
C.0.1 mol·L-1的Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S)
D.NaHS与Na2S以任意比混合的溶液中:c(Na+)+c(H+)=c(HS-)+c(S2-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法不正确的是![]()
A.“酸雨”、“臭氧层受损”、“光化学烟雾”都与氮氧化物有关
B.PM2.5作为空气质量预报的一项重要指标,它是指空气中直径小于或等于2.5m的颗粒物,该值越高,代表空气污染程度越严重
C.静电除尘治理悬浮颗粒污染,其依据是胶体的电泳原理
D.为消除碘缺乏症,卫生部规定食盐中必须加含碘物质,食盐中所加含碘物质是KI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸氯喹在细胞水平上能有效抑制新型冠状病毒的感染,可由氯喹(H)与磷酸在一定条件下制得,它的一种合成方法如下:
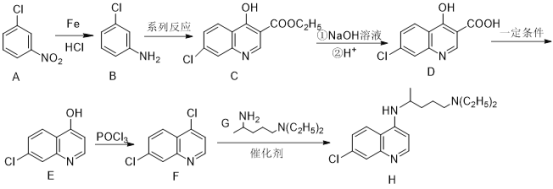
已知: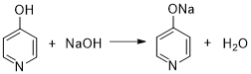
回到下列问题:
(1)A中含有的官能团名称为_____________。
(2)B的分子式为_____________。
(3)碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳原子,H中有_________个手性碳原子。
(4)F→H的反应类型为_____________。
(5)C与NaOH溶液反应的化学方程式为___________________________________________。
(6)E与氢气反应后的产物M的分子式为C9H8NOCl,符合下列条件的M有__________种。
①遇FeCl3溶液发生显色反应 ②除苯环外不含其他环状结构
③苯环上只有2个取代基 ④含有-NH2和![]()
其中核磁共振氢谱有5组峰,且峰面积之比为1:2:2:1:2的M的结构简式为___________。(任写2种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中正反应速率相同B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中CO的物质的量比容器Ⅱ中的少D.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25° C时,二元酸H2X的电离平衡常数K1=5.0×10-2,K2=5.4×10-5。此温度下用AgNO3溶液分别滴定浓度均为0.01mol·L-1的KY和K2X溶液,所得的沉淀(AgY和Ag2X)溶解平衡图像如图所示。下列叙述正确的是
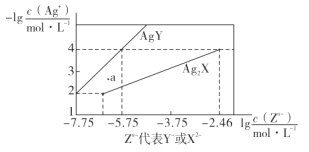
A.25°C时,KHX的溶液pH>7
B.反应Ag2X+2Y- 2AgY+ X2-的平衡常数为103.29
C.a点既可以表示AgY的不饱和溶液也可以表示Ag2X的过饱和溶液
D.向c(Y-)=c(X2-)=0.01 mol·L-1的混合液中滴入AgNO3溶液时,先生成AgY沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com