
【题目】设NA表示阿伏伽德罗常数的数值,下列叙述中正确的是( )
A.常温常压下,48gO3含有的氧原子数为3NA
B.24g金属镁变为镁离子时失去的电子数为NA
C.4℃时9mL水和标准状况下11.2L氮气含有相同的原子数
D.同温同压下,NA个NO与NA个N2和O2的混合气体的体积不相等
【答案】A
【解析】解:A.臭氧分子由氧原子构成,故氧原子的物质的量为 ![]() =3mol,氧原子的数目为3mol×NAmol﹣1=3NA , 故A正确;
=3mol,氧原子的数目为3mol×NAmol﹣1=3NA , 故A正确;
B.24gMg的物质的量为 ![]() =1mol,镁原子失去2个电子变为镁原子,故失去电子的数目为1mol×2×NAmol﹣1=2NA , 故B错误;
=1mol,镁原子失去2个电子变为镁原子,故失去电子的数目为1mol×2×NAmol﹣1=2NA , 故B错误;
C.4℃时9mL水的质量为9mL×1g/mL=9g,水的物质的量为 ![]() =0.5mol,含有原子的物质的量为0.5mol×3=1.5mol.标况下氮气的物质的量为
=0.5mol,含有原子的物质的量为0.5mol×3=1.5mol.标况下氮气的物质的量为 ![]() =0.5mol,氮气分子是双原子分子,含有的原子的物质的量为0.5mol×2=1mol,故二者含有原子数目不相等,故C错误;
=0.5mol,氮气分子是双原子分子,含有的原子的物质的量为0.5mol×2=1mol,故二者含有原子数目不相等,故C错误;
D.同温同压下,分子数目之比等于体积之比,故NA个NO与NA个N2和O2的混合气体的体积相等,故D错误;
故选A.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3 , 还有少量Fe2O3、SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如图所示: 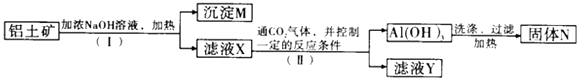
(1)Ⅰ和Ⅱ步骤中分离滤液和沉淀的操作是 .
(2)沉淀M中除含有泥沙外,一定还含有;固体N是 .
(3)滤液X中,含铝元素的溶质的化学式为;它属于(填“酸”“碱”或“盐”)类物质.
(4)实验室里常往AlCl3溶液中加入(填“氨水”或“NaOH溶液”)来制取Al(OH)3 . 发生反应的离子方程式为
(5)向滤液Y中滴加足量盐酸,发生的离子反应方程式为(若没有反应发生,则填“无”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd+2NiO(OH)+2H2O![]() Cd(OH)2+2H2O。下列叙述中不正确的是:( )
Cd(OH)2+2H2O。下列叙述中不正确的是:( )
A. 该电池放电的时候,负极材料是Cd
B. 放电时每转移3mol的电子时,正极有3mol的NiO(OH)被氧化
C. 充电时,阴极附近pH增大
D. 充电时,阳极反应是Cd(OH)2+2e-= Cd + 2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O, 则下列说法正确的是( )
2PbSO4+2H2O, 则下列说法正确的是( )
A. 放电时:当外电路通过1mol的电子时,理论上负极板的质量增加了151.5g
B. 充电时:阳极反应是PbSO4-2e-+2H2O = PbO2+SO42-+4H+
C. 放电时:正极反应是Pb-2e-+SO42-= PbSO4
D. 充电时:铅蓄电池的阴极应与电源的正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体.相应的实验过程如图: 
(1)写出实验过程中所用试剂(写化学式):
试剂①;试剂③ .
(2)判断试剂①已过量的方法是: .
(3)用离子方程式表示加入试剂②的作用:
(4)操作①是利用半透膜进行分离提纯.
操作①的实验结果:淀粉(填“能”或“不能”)透过半透膜;SO42﹣(填“能”或“不能”)透过半透膜.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.二氧化硫能使紫色石蕊试液变红B.干燥的氯气能使pH试纸先变红后褪色
C.常温下,铁和浓硫酸会反应D.碳酸氢钠可与盐酸反应,故可作治疗胃酸过多的药剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的数值,下列叙述中正确的是( )
A.常温常压下,48gO3含有的氧原子数为3NA
B.24g金属镁变为镁离子时失去的电子数为NA
C.4℃时9mL水和标准状况下11.2L氮气含有相同的原子数
D.同温同压下,NA个NO与NA个N2和O2的混合气体的体积不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。
(1)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H<0
N2(g)+2CO2(g) △H<0
①一定条件下,将体积比为1:2的NO、CO气体置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_________(填字母)。
A.体系压强保持不变 B.混合气体颜色保持不变
C. N2和CO2的体积比保持不变 D. v正(CO)=2v逆(N2)
②20min时,若改变反应条件,导致N2浓度发生如下图1所示的变化,则改变的条件可能是_____(填字母)。
A.加入催化剂 B.降低温度 C.增加CO2量 D.缩小容器体积
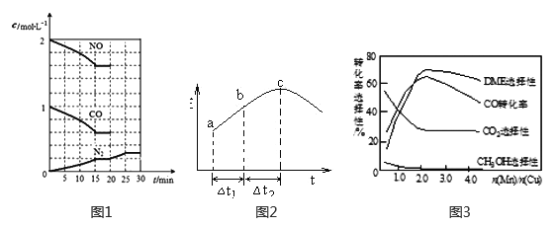
(2)在一定条件下,将SO2和NO2通入绝热恒容密闭容器中,发生反应:SO2(g)+NO2(g) ![]() SO3(g)+NO(g),正反应速率随时间变化如图2所示。由图可得出的正确结论是_____________(填字母)。
SO3(g)+NO(g),正反应速率随时间变化如图2所示。由图可得出的正确结论是_____________(填字母)。
A.反应在c点达到平衡状态
B.反应物浓度:b点小于c点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2 时,SO2的转化率:a~b段小于b~c段
(3)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2可制备二甲醚(DME)。观察图3回答问题。催化剂中n(Mn)/n(Cu)约为__________时最有利于二甲醚的合成。
(4)工业上可以用CO和H2生产燃料甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H=-92.9kJ/mol, 300℃,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
CH3OH(g) △H=-92.9kJ/mol, 300℃,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1molCO、2molH2 | lmolCH3OH | 2molCH3OH | |
平衡 时的 数据 | CH3OH/mol·L-1 | c1 | c2 | c3 |
反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ | |
体系压强/Pa | p1 | p2 | p3 | |
反应物转化率 | a1 | a2 | a3 | |
下列说法中正确的是______
A.2c1>c3 B. a+b=92.9 C.2p23 D.a1+a3<1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com