
【题目】下列说法正确的是
A. 在加热、甲醛、饱和(NH4)2SO4溶液、X射线作用下,蛋白质都会发生变性
B. 氨基酸、蛋白质、油脂都含有C、H、O、N四种元素
C. 生活中食用的食醋、植物油、动物蛋白等物质都是混合物
D. 乙烯、聚乙烯、苯均能使酸性高锰酸钾溶液褪色
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】大气中的部分碘源于![]() 对海水中
对海水中![]() 的氧化。其科学小组进行
的氧化。其科学小组进行![]() 与含
与含![]() 溶液反应的相关研究:
溶液反应的相关研究:
(1)![]() 将
将![]() 氧化生成
氧化生成![]() 的过程由3步反应组成:
的过程由3步反应组成:
①![]()
![]()
②![]()
![]()
③![]()
![]()
用热化学方程式表示![]() 氧化
氧化![]() 生成
生成![]() 的反应______。
的反应______。
(2)![]() 在水中易分解,一定条件下,
在水中易分解,一定条件下, ![]() 的浓度减少一半时所需的时间(t)如下表所示。已知:
的浓度减少一半时所需的时间(t)如下表所示。已知: ![]() 的起始浓度为
的起始浓度为![]()
pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
①![]() 增大能加速
增大能加速![]() 分解,表明对
分解,表明对![]() 分解起催化作用的是___________。
分解起催化作用的是___________。
②根据表中数据,推测![]() 在下列条件下分解速率依次增大的顺序为__________(填字母代号)
在下列条件下分解速率依次增大的顺序为__________(填字母代号)
a. 40℃、![]() b. 10℃、
b. 10℃、![]() c. 30℃、
c. 30℃、![]()
(3)![]() 在KI溶液中存在下列平衡:
在KI溶液中存在下列平衡:![]() 。测得不同温度下该反应的平衡常数如图所示,下列说法正确的是__________。
。测得不同温度下该反应的平衡常数如图所示,下列说法正确的是__________。

A. 反应![]() 的
的![]()
B. 利用该反应可以除去硫粉中少量的碘单质
C. 在上述平衡体系中加入苯,平衡不移动
D. 25℃时,在上述平衡体系中加入少量![]() 固体,平衡常数K小于680
固体,平衡常数K小于680
(4)将![]() 溶于
溶于![]() 中,得到紫红色的溶液,再加入一定浓度的
中,得到紫红色的溶液,再加入一定浓度的![]() 溶液,现象如图所示:
溶液,现象如图所示:

①上层溶液中含碘元素的微粒有_______________(用化学符号表示)。
②由实验现象可推测关于![]() 溶解性的结论是______________。
溶解性的结论是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 18g2H2O中含有的中子数为10NA
B. 11.2 LCl2与足量NaOH 溶液反应时转移的电子数为0.5 NA
C. 1mol·L-1的Fe2(SO4)3溶液中含有的SO42-数为3 NA
D. 7 g 乙烯和丁烯的混合气体中所含的碳原子数是0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应:M(g)+N(g)![]() P(g)+Q(g) ΔH>0。请回答下列问题:
P(g)+Q(g) ΔH>0。请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为________;该温度时的平衡常数K=________。
(2)若反应温度升高,则M的转化率________(填“增大”“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=a mol·L-1,达到平衡后,c(P)=2 mol·L-1,则a=________。
(4)若反应温度不变,反应物的起始浓度为c(M)=c(N)=b mol·L-1,达到平衡后,M的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组探究实验室中制备Cl2的过程,为证明过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如下图所示的实验装置,按要求回答问题。
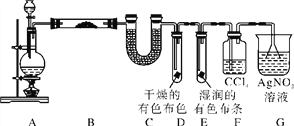
(1)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12 L的原因是________________________。
(2)①装置B中盛放的试剂名称为_______,作用是___________,现象是___________。
②装置D和E中出现的不同现象说明的问题是_______________________________。
③装置F的作用是____________________。
④写出装置G中发生反应的离子方程式:__________。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在________与________之间(填装置字母序号),装置中应加入________(填写试剂或用品名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法中,不正确的是( )
A.漂白粉能漂白是因为Ca(ClO)2中的 ClO-有强氧化性B.明矾能够杀菌消毒是利用了胶体的吸附性
C.碳酸镁、小苏打等可用于治疗胃酸过多D.二氧化硅可用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化铜是一种常用试剂。如:利用新制氢氧化铜验证乙醛的还原性。
(1)新制氢氧化铜悬浊液的配制:在试管里加入10%的氢氧化铜溶液2mL,滴入2%的硫酸铜溶液4~6滴,振荡。这样操作的目的是________________________。
(2)下面是某研究性学习小组开展的探究性学习活动:
提出问题:对“乙醛与新制氢氧化铜悬浊液反应生成的红色沉淀是Cu2O”提出质疑,他们认为红色沉淀不一定是氧化亚铜。为了确定红色沉淀的成分,进行了如下探究:
提出猜想:________________________。
查阅资料:①氧化亚铜属于碱性氧化物;
②+1价的铜离子在酸性条件下易发生自身氧化还原反应;
③在空气中灼烧氧化亚铜生成氧化铜。
设计方案:
方案1:取该红色沉淀于足量的稀硝酸中,观察溶液颜色变化;
方案2:取该红色沉淀溶于足量的稀硝酸中,观察是否有残渣;
方案3:称取该红色沉淀ag,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称量,反复多次,直到固体恒重,称得质量为bg,比较a、b的大小;
方案4:取红色沉淀放于大试管里,加入酸化的硝酸银溶液,观察是否有银白色的银析出。
你认为合理的方案是____________。
(3)质量分数为11.6%的某饱和一元醛水溶液5g,跟足量新制的Cu(OH)2悬浊液反应,生成Cu2O1.44g。这种醛是________,结构简式为________。它与足量新制Cu(OH)2悬浊液反应的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮可以形成多种离子,如N3-、NH2-、N3-、NH4+、N2H5+等。已知N2H5+离子的形成过程类似NH4+的形成过程,N2H5+在碱性溶液中生成电中性的分子和水,试填写下列空白。
(1)该电中性分子的化学式为________________________。
(2)N2H5+离子的电子式为______________________。
(3)写出两种由多原子组成的含有与N3-电子数相同的分子的化学式_______、________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com