
【题目】以 NA表示阿伏加德罗常数的值,下列说法正确的是( )

A. 18g 冰(图甲)中含 O﹣H 键数目为 4NA
B. 28g 晶体硅(图乙)中含有σ键数目为 4NA
C. 44g 干冰(图丙)中含有 0.25NA个晶胞结构单元
D. 石墨烯(图丁)是碳原子单层片状新材料,12 g石墨烯中含σ键数目为 3 NA
【答案】C
【解析】
A.1个水分子中含有2个O﹣H 键;
B. 硅晶体中,每个硅原子与其它4个Si形成4个Si-Si 键,根据均摊法计算出1mol硅形成的Si-Si数目;
C.二氧化碳晶体是立方面心结构,1个晶胞结构单元含有4个二氧化碳分子;
D.在石墨烯中,每个碳原子周围有两个C-C单键和一个C=C双键,所以每个碳原子实际占化学键为1.5个,据此判断。
A. 1个水分子中含有2个O﹣H键,18g 冰的物质的量为1mol,含有O﹣H 键数目为 2NA,故A错误;
B. 28g 晶体硅中含有1molSi原子,晶体硅中,每个硅原子与其它4个Si形成4个Si-Si键,则每个硅原子形成的共价键为:1/2×4=2,则1mol单质硅含有2molSi-Si键,含有2NA 个Si-Si键,故B错误;
C. 1个晶胞结构单元含有4个二氧化碳分子,44g干冰物质的量为1mol,含有晶胞结构单元个数0.25NA个,故C正确;
D. 在石墨烯中,每个碳原子周围有两个C-C单键和一个C=C双键,所以每个碳原子实际占化学键为1.5个,12 g石墨烯即1 mol 所含碳碳键数目为1.5 NA,故D错误;
综上所述,本题选C。


科目:高中化学 来源: 题型:
【题目】I.钠、铝和铁是中学化学常见的三种重要金属。请回答下列问题:
(1)钠在空气中燃烧生成淡黄色的__________ (填“Na2O”或“Na2O2”);
(2)Al2O3能溶于酸或强碱溶液生成盐和水,则是一种___________(填“酸性”、“碱性”或“两性”)氧化物;
(3)Fe(OH)3不溶于水,但能溶于酸,请写出Fe(OH)3与盐酸反应的化学方程式:_____________。
II.氮、硫的化合物与人类生活和生产有着密切的联系。请回答下列问题:
(1)在空气质量报告的各项指标中,有SO2和NO2的指数,SO2是一种无色有毒气体,NO2是一种_________(填“无色”或“红棕色”)有毒气体;
(2)氨气极易溶于水,其水溶液显__________(填“酸”、“碱”或“中”)性;
(3)加热时,浓硫酸可与碳发生反应:C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O。在该反应中,浓H2SO4表现出___________(填“吸水”、“脱水”或“氧化”)性。
CO2↑+2SO2↑+2H2O。在该反应中,浓H2SO4表现出___________(填“吸水”、“脱水”或“氧化”)性。
III.乙醇和乙酸是生活中两种常见的有机物。请回答下列问题:
(1)乙醇的结构简式为CH3CH2OH,乙醇分子含有的官能团为__________;
(2)生活中常用食醋除去暖瓶内的水垢(主要成分是CaCO3),反应的化学方程式为2CH3COOH+CaCO3=(CH3COO)2Ca+CO2↑+H2O。通过这个事实,你得出醋酸与碳酸的酸性强弱关系是:醋酸_____碳酸(填“>”或“<”);
(3)在浓硫酸的催化作用下,加热乙酸和乙醇的混合溶液,可发生酯化反应。请完成化学方程式:CH3COOH + CH3CH2OH![]() CH3COOCH2CH3+________。
CH3COOCH2CH3+________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO可用于合成甲醇,化学方程式为CO(g)+2H2(g)CH3OH(g)。
(1)下图是反应CO(g)+2H2(g)CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。

①T1和T2温度下的平衡常数大小关系是K1________(填“>”、“<”或“=”)K2。在T1温度下,往体积为1 L的密闭容器中,充入1 mol CO和2 mol H2,经测得CO和CH3OH(g)的浓度随时间变化如图所示。则该反应的平衡常数为____ 。

②若容器容积不变,下列措施可增加CO转化率的是________(填字母)。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2)在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线z对应的温度是________℃;该温度下上述反应的化学平衡常数为________。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol SO2和1 mol O2通入体积不变的密闭容器中,在一定条件下发生反应2SO2(g)+O2(g)![]() 2SO3(g),达到平衡时SO3为0.3 mol,此时若移走0.5 mol O2和0.5 mol SO2,相同温度下再次达到新平衡时SO3的物质的量为
2SO3(g),达到平衡时SO3为0.3 mol,此时若移走0.5 mol O2和0.5 mol SO2,相同温度下再次达到新平衡时SO3的物质的量为
A. 0.3 mol B. 0.15 mol
C. 小于0.15 mol D. 大于0.15 mol,小于0.3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列实验。(a、b为弹餐夹,其他装置略去)
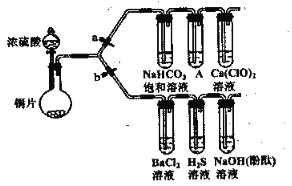
I验证SO2具有氧化性、还原性和酸性氧化物的通性。
(1) 连接仪器、检查装置气密性、加药品后,打开b (关闭a),然后滴入浓硫酸,加热。装有浓硫酸的仪器名称是___________,铜与浓硫酸反应的化学方程式是___________ 。
(2) 能验证SO2具有氧化性的实验现象是__________________________________________。
(3) 装有BaCl2溶液的试管中无任何现象,将其分成两份,分别滴加氨水和氯水,均产生白色沉淀,沉淀的化学式分别是___________,___________。写出其中SO2显示还原性并生成白色沉淀的总的离子方程式____________________________________________。
(4) 能验证SO2具有酸性氧化物的通性的实验现象是________________________________, 若通入过量的SO2,其化学方程式是____________________________________________。
II验证酸性的相对强弱:碳酸>次氯酸。(已知酸性:亚硫酸>碳酸)
(5) 打开a关闭b。装置A中的足量的试剂是___________。利用该装置能否判断碳酸的酸性比次氯酸强,理由是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)是一种砖红色粉末状固体,几乎不溶于水,可在酸性溶液中发生反应,与硫酸、盐酸、硝酸反应如下:
①Cu2O+H2SO4=CuSO4+Cu+H2O
②Cu2O+4HCl=2HCuCl2+H2O
③3Cu2O+14HNO3(稀)=6Cu(NO3)2+2NO↑+7H2O
(1)Cu2O中Cu元素的化合价为________。
(2)反应①中氧化剂为_________,还原剂为_________(填具体物质的化学式)。
(3)反应②_________(填“是”或“不是”)氧化还原反应;若是请说明转移电子情况,若不是请说明判断依据:_____________________________________。
(4)请写出反应③的离子方程式并用单线桥法标出电子转移的方向和数目:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从铜电解工艺的阳极泥中提取Se和Te的流程如下:

下列叙述错误的是( )
A. 合理处理阳极泥有利于保护环境和资源再利用
B. 流出液是H2SO4溶液
C. 电解过程中阴极上析出单质Te
D. “焙砂”与碳酸钠充分混合后,可在瓷坩锅中焙烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是

A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com