
����Ŀ��I.�ơ�����������ѧ��ѧ������������Ҫ��������ش��������⣺
��1�����ڿ�����ȼ�����ɵ���ɫ��__________ ���Na2O����Na2O2������
��2��Al2O3���������ǿ����Һ�����κ�ˮ������һ��___________������ԡ��������ԡ������ԡ��������
��3��Fe(OH)3������ˮ�����������ᣬ��д��Fe(OH)3�����ᷴӦ�Ļ�ѧ����ʽ��_____________��
II.������Ļ���������������������������е���ϵ����ش��������⣺
��1���ڿ�����������ĸ���ָ���У���SO2��NO2��ָ����SO2��һ����ɫ�ж����壬NO2��һ��_________(���ɫ������ɫ��)�ж����壻
��2��������������ˮ����ˮ��Һ��__________(��ᡱ��������С�)�ԣ�
��3������ʱ��Ũ�������̼������Ӧ��C+2H2SO4(Ũ) ![]() CO2��+2SO2��+2H2O���ڸ÷�Ӧ�У�ŨH2SO4���ֳ�___________(���ˮ��������ˮ����������)�ԡ�
CO2��+2SO2��+2H2O���ڸ÷�Ӧ�У�ŨH2SO4���ֳ�___________(���ˮ��������ˮ����������)�ԡ�
III.�Ҵ������������������ֳ������л����ش��������⣺
��1���Ҵ��Ľṹ��ʽΪCH3CH2OH���Ҵ����Ӻ��еĹ�����Ϊ__________��
��2�������г���ʳ�׳�ȥůƿ�ڵ�ˮ��(��Ҫ�ɷ���CaCO3)����Ӧ�Ļ�ѧ����ʽΪ2CH3COOH+CaCO3=(CH3COO)2Ca+CO2��+H2O��ͨ�������ʵ����ó�������̼�������ǿ����ϵ�ǣ�����_____̼��(�>����<��)��
��3����Ũ����Ĵ������£�����������Ҵ��Ļ����Һ���ɷ���������Ӧ������ɻ�ѧ����ʽ��CH3COOH + CH3CH2OH![]() CH3COOCH2CH3+________��
CH3COOCH2CH3+________��
���𰸡�Na2O2 ���� Fe(OH)3+3HCl=FeCl3+3H2O ����ɫ �� ���� -OH���ǻ� > H2O
��������
��.��1�����ڿ�����ȼ��2Na+O2![]() Na2O2���۲쵽������ɫ�Ļ��棬���ɵ���ɫ����Na2O2���ʴ�Ϊ��Na2O2��
Na2O2���۲쵽������ɫ�Ļ��棬���ɵ���ɫ����Na2O2���ʴ�Ϊ��Na2O2��
��2�����ܺ��ᷴӦ�����κ�ˮ���ܺͼӦ�����κ�ˮ������������������Al2O3���ᡢ�Ӧ��������ˮ����������������ʴ�Ϊ��������
��3��Fe(OH)3�����ᷢ���кͷ�Ӧ�����ֻ�����������ɷ֣������Ȼ�����ˮ����ӦΪ��Fe(OH)3+3HCl=FeCl3+3H2O���ʴ�Ϊ��Fe(OH)3+3HCl=FeCl3+3H2O��
��.��1��SO2��һ����ɫ�ж����壬NO2��һ�ֺ���ɫ�ж����壬�ܹ�����ˮ����ˮ��Ӧ���������NO���ʴ�Ϊ������ɫ��
��2��������������ˮ������ˮ��ˮ������Ӧ����һˮ�ϰ�����������һԪ�������������������ӣ�ʹˮ��Һ�Լ��ԣ�������ˮ��Һ�Լ��ԣ��ʴ�Ϊ���
��3������ʱ��Ũ�������̼������Ӧ��C+2H2SO4(Ũ)![]() CO2��+2SO2��+2H2O���ڸ÷�Ӧ�У�ŨH2SO4�е�SԪ�ػ��ϼ���+6�ۣ���Ӧ���ΪSO2�е�+4�ۣ����ϼ۽��ͣ���õ��ӣ�����Ũ������ֳ����������ʴ�Ϊ��������
CO2��+2SO2��+2H2O���ڸ÷�Ӧ�У�ŨH2SO4�е�SԪ�ػ��ϼ���+6�ۣ���Ӧ���ΪSO2�е�+4�ۣ����ϼ۽��ͣ���õ��ӣ�����Ũ������ֳ����������ʴ�Ϊ��������
��.��1���Ҵ��Ľṹ��ʽΪCH3CH2OH���Ҵ����Ӻ��е�-OH���Ҵ��Ļ�ѧ������������ã������Ҵ��Ĺ�����Ϊ-OH���������ǻ����ʴ�Ϊ��-OH���ǻ���
��2�����ݸ��ֽⷴӦ�Ĺ��ɣ�ǿ����������η�����Ӧ����ǿ���κ����ᣬ��Ϸ�Ӧ����ʽ��2CH3COOH+CaCO3=(CH3COO)2Ca+CO2��+H2O����֪���ʵ����ԣ�CH3COOH>H2CO3���ʴ�Ϊ������
��3����Ũ����Ĵ������£�����������Ҵ��Ļ����Һ���ɷ���������Ӧ����������������ˮ����Ӧ�ķ���ʽ�ǣ�CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O������ȱ�ٵ�������H2O���ʴ�Ϊ��H2O��
CH3COOCH2CH3+H2O������ȱ�ٵ�������H2O���ʴ�Ϊ��H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��CO(g)��H2O(g)![]() CO2(g)��H2(g)����H����41 kJ��mol��1����ͬ�¶��£����ݻ���ͬ�����������ܱ������У�����һ�����ķ�Ӧ�����Ӧ������������£�
CO2(g)��H2(g)����H����41 kJ��mol��1����ͬ�¶��£����ݻ���ͬ�����������ܱ������У�����һ�����ķ�Ӧ�����Ӧ������������£�
������� | ��ʼʱ���������ʵ���/mol | ��ƽ�������ϵ�����ı仯 | |||
CO | H2O | CO2 | H2 | ||
�� | 1 | 4 | 0 | 0 | �ų�������32.8 kJ |
�� | 0 | 0 | 1 | 4 | �����仯��Q kJ |
����˵���У�����ȷ����(����)
A. �������з�Ӧ��ƽ��ʱ��CO��ת����Ϊ80%
B. ��������CO��ת���ʵ�����������CO2��ת����
C. ƽ��ʱ����������CO2��Ũ�����
D. ������ʱCO�ķ�Ӧ���ʵ���H2O�ķ�Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ά����C�Ľṹ��ʽ��ͼ��ʾ������˵���������

A. 1molά����C�����ӳɷ�Ӧ��������Ҫ1molH2
B. ά����C������ˮ
C. ά����C�Ķ��ȴ��ﳬ������
D. ά����C������ԭ�Ӳ����ܴ���ͬһƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�������ʵ�鷽�����Է���KCl��BaCl2���ֹ�������Իش��������⣺

��ѡ�Լ���Na2SO4��Һ��K2CO3��Һ��K2SO4��Һ������
(1)�����ٵ�������________�������ڵ�������____________��
(2)�Լ�a��____________(�ѧʽ����ͬ)���Լ�b��__________,����B��____________��
(3)�����Լ�a��������Ӧ�Ļ�ѧ����ʽΪ__________________________________��
�����Լ�b��������Ӧ�Ļ�ѧ����ʽΪ____________________________________��
(4)�÷����ܷ�ﵽʵ��Ŀ�ģ�__________________________(��ܡ����ܡ�)�������ܣ�Ӧ��θĽ���(���ܣ����ʲ��ûش�)__________��
(5)��Ҫ�ⶨԭ�������BaCl2����������������Ҫȷ���������������⣬���ٻ�Ҫ��õ�������____��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
��1��NO2����ˮ���գ���Ӧ�Ļ�ѧ��Ӧ����ʽΪ_____________________
��2����֪��2SO2(g)��O2(g)![]() 2SO3(g) ��H��-196.6kJ��mol��1
2SO3(g) ��H��-196.6kJ��mol��1
2NO(g)��O2(g)![]() 2NO2(g)����H��-113.0 kJ��mol��1
2NO2(g)����H��-113.0 kJ��mol��1
��ӦNO2(g)��SO2(g) ![]() SO3(g)��NO(g) �Ħ�H��________kJ��mol��1
SO3(g)��NO(g) �Ħ�H��________kJ��mol��1
��3��һ�������£���NO2��SO2�������1��2�����ܱ������з���������Ӧ�����������Ӧƽ��ʱNO2��SO2�����Ϊ1��6����ƽ�ⳣ��K��________ ��������λС����
��4��CO�����ںϳɼ״�����Ӧ����ʽΪCO(g)��2H2(g) ![]() CH3OH(g)��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��ʾ���÷�Ӧ��H________0(�>����<��)��ʵ����������������250�桢1.3��104kPa���ң�ѡ���ѹǿ��������____________________
CH3OH(g)��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��ʾ���÷�Ӧ��H________0(�>����<��)��ʵ����������������250�桢1.3��104kPa���ң�ѡ���ѹǿ��������____________________

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯīϩ����ص���Ʊ�Fe(OH)2��װ����ͼ��ʾ����طŵ�ʱ�ķ�ӦΪ16Li+xS8==8Li2Sx(2��x��8)�������������Ϸֱ�ΪFe��ʯī������һ��ʱ����Ҳಣ�����в��������İ�ɫ����������˵������ȷ����
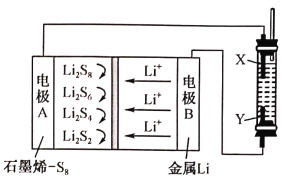
A. X�����缫������������Ӧ
B. ���������ķ���B��Y��X��A
C. �����ɷ�����Ӧ��2Li2S6+2Li++2e��=3Li2S4
D. ﮵缫����0.14gʱ����������Һ����0.18g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס������ص缫���϶���������̼������ش��������⣺

��1���������е������Һ��ΪCuSO4��Һ����Ӧһ��ʱ���
���к�ɫ�����������Ǽ׳��е�________�����ҳ��е�________����
���ҳ��������ĵ缫��Ӧʽ��_________________________________________________��
��2���������о�Ϊ����NaCl��Һ��
��д���ҳ����ܷ�Ӧ�����ӷ���ʽ_____________________________________________��
�ڼ׳���̼���ϵ缫��Ӧʽ��_________________________________________________��
�ҳ���̼���ϵ缫��Ӧ����________(�������Ӧ����ԭ��Ӧ��)��
�����ҳ�ת��0.02 mol e����ֹͣʵ�飬������Һ�����200 mL������Һ���Ⱥ��c(OH--)��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��W��X��Y��Z��ԭ�����������������ǵ�ԭ�������������ܺ͵���Z��ԭ����������������Ԫ�����һ�ֻ�����M�����������������ƶ���ȷ����

A. ԭ�Ӱ뾶��Z��Y��X��W
B. ����������Ӧ��ˮ�������ԣ�Y��X
C. �������ӵĻ�ԭ�ԣ�W��Z
D. W��Y��Z��ɵĻ�����ֻ�����ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� NA��ʾ�����ӵ�������ֵ������˵����ȷ����(������

A. 18g ��(ͼ�ף��к� O��H ����ĿΪ 4NA
B. 28g �����(ͼ�ң��к��ЦҼ���ĿΪ 4NA
C. 44g �ɱ�(ͼ�����к��� 0.25NA�������ṹ��Ԫ
D. ʯīϩ(ͼ������̼ԭ�ӵ���Ƭ״�²��ϣ�12 gʯīϩ�к��Ҽ���ĿΪ 3 NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com