
【题目】通过膜电池可除去废水中的乙酸钠和对氯笨酚(![]() ),其原理如下图所示,下列说法正确的是
),其原理如下图所示,下列说法正确的是

A. B为电池的正极,发生还原反应
B. 电流方向从B极沿导线经小灯泡流向A极
C. A极的电极反应式为:![]()
D. 当外电路中有0.2mole-转移时,A极区增加的H+的数目为0.1NA
科目:高中化学 来源: 题型:
【题目】已知有机物C的分子式为C9H9OCl,分子中有一个苯环,苯环上只有一个侧链且不含甲基,一定条件下C能发生银镜反应。C与其他物质之间的转化如图所示(部分无机产物已略去):
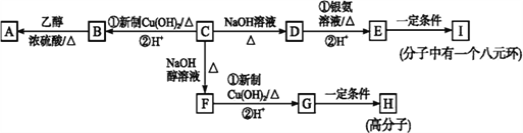
(1)F中官能团的名称是_____________________;C→F的反应类型是____________。
(2)C的结构简式是______________________,I的结构简式是__________________。
(3)D与银氨溶液反应的化学方程式为_________________________________。
(4)有的同学认为B中可能没有氯原子,理由是_______________________。
(5)D的一种同系物W(分子式为C8H8O2)有多种同分异构体,则符合以下条件的W的同分异构体有________种,写出其中核磁共振氢谱有4个峰且能发生银镜反应的结构简式___________________。
①属于芳香族化合物
②遇FeCl3溶液不变紫色
③能与NaOH溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的性质或用途说法正确的是
A. 铝的表面易形成致密氧化物薄膜,故铝制器皿耐腐蚀
B. 合金的硬度和熔点都高于成分金属
C. SiO2不能与任何酸发生反应
D. 明矾常用于水的净化和消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种元素中,单质的氧化性最强的是 ( )
A. 原子最外层电子数为次外层电子数的2倍 B. 第16号元素
C. 原子核外L层电子数为K层电子数的三倍 D. 第三周期IIIA族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在日常生活中有着广泛的应用,下列有关说法正确的是
选项 | 化学反应方程式 | 相关说法 |
A | H2S+4O2F2 | 氧气是氧化产物,O2F2是氧化剂又是还原剂 |
B | Cl2+2Br-=2Cl-+Br2 Zn+Cu2+=Zn2++Cu | 均为单质被还原的置换反应 |
C | 4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+ | 若Fe2+失去4mol电子,生成氧气的体积约为22.4L |
D | HNCO+NOx | 若NOx中x=2,1mol NO2在反应中转移4NA个电子 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体在有机合成、无机合成等方面有着重要应用。咪唑是合成“离子液体”的一种原料,其结构如图所示。下列有关咪唑说法不正确的是
![]()
A. 化学式C3H4N2
B. 分子中含有一种非极性键和两种极性键
C. 可以发生取代、加成、氧化反应
D. 一氯取代物的同分异构体共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法与图示含义不相符合的是
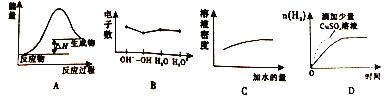
A. 可用图A表示炭粉和二氧化碳反应的能量变化
B. 可用图B表示个粒子核外电子数
C. 可用图C表示硫酸加水稀释的密度变化
D. 可用图D表示一定量的硫酸溶液和过量锌粉反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛性能优越,被称为继铁、铝之后的“第三金属”,工业上用钛矿石(主要成分:FeO、TiO2,SiO2等)为原料制取钛,工艺流程如下,回答下列问题:

已知:TiO2(s)+H2SO4(aq)=TiOSO4(aq)+H2O
(1)钛矿石在加入浓硫酸酸溶前要先粉碎,其目的是__________。
(2)操作1名称为_______,固体2的主要成分是______, 写出金属钠与TiCl4共热的化学反应方程式_________________。
(3)一定温度下,在一个固定容积的容器中发生反应:TiO2(s)+2Cl2(g)+2C(s)![]() TiCl4(g)+2CO(g),反应中氧化剂是________,下列说法能够说明该反应已达化学平衡状态的是_________________。
TiCl4(g)+2CO(g),反应中氧化剂是________,下列说法能够说明该反应已达化学平衡状态的是_________________。
A.反应每断裂2个Cl一Cl键,同时生成2 个C![]() O键
O键
B. 容器内压强不再发生变化
C. Cl2和TiCl4的浓度不再变化
D.v(TiCl4)正=2v(C)逆
(4)将50吨钛矿石经上述变化后,最终可得金属钛12吨,假设各步反应均完全,则原矿石中TiO2的百分含量为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com