
【题目】金属钛性能优越,被称为继铁、铝之后的“第三金属”,工业上用钛矿石(主要成分:FeO、TiO2,SiO2等)为原料制取钛,工艺流程如下,回答下列问题:

已知:TiO2(s)+H2SO4(aq)=TiOSO4(aq)+H2O
(1)钛矿石在加入浓硫酸酸溶前要先粉碎,其目的是__________。
(2)操作1名称为_______,固体2的主要成分是______, 写出金属钠与TiCl4共热的化学反应方程式_________________。
(3)一定温度下,在一个固定容积的容器中发生反应:TiO2(s)+2Cl2(g)+2C(s)![]() TiCl4(g)+2CO(g),反应中氧化剂是________,下列说法能够说明该反应已达化学平衡状态的是_________________。
TiCl4(g)+2CO(g),反应中氧化剂是________,下列说法能够说明该反应已达化学平衡状态的是_________________。
A.反应每断裂2个Cl一Cl键,同时生成2 个C![]() O键
O键
B. 容器内压强不再发生变化
C. Cl2和TiCl4的浓度不再变化
D.v(TiCl4)正=2v(C)逆
(4)将50吨钛矿石经上述变化后,最终可得金属钛12吨,假设各步反应均完全,则原矿石中TiO2的百分含量为_____________。
【答案】 增大反应物的接触面积,使反应速率加快 过滤 FeSO4(FeSO4·7H2O等合理都行) 4Na+TiCl4 ![]() Ti+4NaCl 氯气 BC 40%
Ti+4NaCl 氯气 BC 40%
【解析】(1)矿石粉碎能够增大酸浸时的接触面积,加快酸浸的速率;(2)由框图可知:原料是钛铁矿,主要产品是钛,副产品为绿矾和硫酸,由信息可知:框图的第一步反应为:TiO2+H2SO4===TiOSO4+H2O,框图的第二步中加入水和过量铁,加入物质铁的目的是防止Fe2+被氧化,那么固体2无疑是硫酸亚铁。操作1得到固体和液体,只能是过滤;金属钠与TiCl4共热产生金属钛,故为置换反应,由此可写出对应的化学方程式;(3)根据反应TiO2(s)+2Cl2(g)+2C(s)![]() TiCl4(g)+2CO(g),反应前后Ti化合价没有变化,氯的化合价降低,故氧化剂为氯气;A.反应每断裂2个Cl-Cl键,同时生成2个C≡O键,均为正反应速率,错误;B.容器内压强不再发生变化,即气体分子数不变,说明已经达到平衡状态,正确;C. Cl2和TiCl4的浓度不再变化,说明达到平衡,正确;D. 固体的浓度为定值,不能用于描述反应速率,错误。
TiCl4(g)+2CO(g),反应前后Ti化合价没有变化,氯的化合价降低,故氧化剂为氯气;A.反应每断裂2个Cl-Cl键,同时生成2个C≡O键,均为正反应速率,错误;B.容器内压强不再发生变化,即气体分子数不变,说明已经达到平衡状态,正确;C. Cl2和TiCl4的浓度不再变化,说明达到平衡,正确;D. 固体的浓度为定值,不能用于描述反应速率,错误。
(4)根据物质的变化不难写出化学方程式,根据关系式
TiO2——Ti
80 48
20 12 可得百分含量为20/50×100%=40%。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】氮及其化合物在生活及工业生产中有着重要应用。请回答以下问题:
(1)下图是N2(g)、H2(g)与NH3(g)之间转化的能量关系图,则:
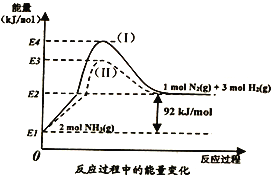
①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为__________________________。
②过程(I)和过程(Ⅱ)的反应热__________(填“相同”或“不同”),原因是_______________。
③一定温度下,在容积为1L的密闭容器中充入1 mol N2(g)、3molH2(g),达到平衡时,混合气体的总量为2.8 mol,则该条件下反应 N2(g)+3H2(g)![]() 2NH3(g)的平衡常数为__________,H2的平衡转化率为__________________________。
2NH3(g)的平衡常数为__________,H2的平衡转化率为__________________________。
(2)用NH3可以消除氮氧化物的污染,已知:
反应I:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H1= a kJ/mol
2N2(g)+6H2O(g) △H1= a kJ/mol
反应Ⅱ:N2(g)+O2(g)![]() 2NO(g) △H2= b kJ/mol
2NO(g) △H2= b kJ/mol
反应Ⅲ:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H3= c kJ/mol
5N2(g)+6H2O(g) △H3= c kJ/mol
则:反应Ⅱ中的b=______ kJ/mol(用含a、c的代数式表示),反应Ⅲ中的△S________0(填“>”“<”或“=”)。
(3)在恒容的密闭容器中,充入一定量的NH3和NO进行上述反应Ⅲ,测得不同温度下反应体系中NH3的转化率(α)与压强p的关系如图:

①分析得P1_________P2 (填“>”“<”或“=”)。
②下列叙述中,不能判断反应Ⅲ己经达到平衡状态的标志是__________(填序号)。
a. N2的浓度不再改变 b.断裂6molN-H键的同时,有6molH-O键形成
C.容器中压强不再变化 d.混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过膜电池可除去废水中的乙酸钠和对氯笨酚(![]() ),其原理如下图所示,下列说法正确的是
),其原理如下图所示,下列说法正确的是

A. B为电池的正极,发生还原反应
B. 电流方向从B极沿导线经小灯泡流向A极
C. A极的电极反应式为:![]()
D. 当外电路中有0.2mole-转移时,A极区增加的H+的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离和提纯的实验中,所选用的方法或仪器不正确的是( )
序号 | A | B | C | D |
实验目的 | 分离食盐水与泥沙 | 分离水和CCl4 | 制取蒸馏水 | 从浓食盐水中得到氯化钠晶体 |
分离方法 | 过滤 | 萃取 | 蒸馏 | 蒸发 |
选用仪器 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉、淀粉酶、基因(DNA片段)的基本单体依次是( )
A. 葡萄糖、蛋白质、DNA B. 蔗糖、氨基酸、核糖核苷糖
C. 葡萄糖、氨基酸、脱氧核苷酸 D. 麦芽糖、多肽、核苷糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学方程式为3MnO2+6KOH+KClO3![]() 3K2MnO4+KCl+3H2O,下列说法中正确的( )
3K2MnO4+KCl+3H2O,下列说法中正确的( )
A. 反应中MnO2是氧化剂 B. 该反应属于复分解反应
C. KClO3在反应中失去电子 D. 反应中每生成lmol K2MnO4,氧化剂得到2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高三一年的化学复习,学生要抓住两方面,一方面是教材,另一方面是历年的高考真题。每年的高考题,在教材中几乎都能找到影子,所以同学们一定要紧紧抓住教材,根据《必修一》第三章和第四章的内容回答下列问题:
(1)实验3-1是取用钠单质的实验,用品有小刀,_____、_____、培养皿。
(2)铁是人类应用最广泛,铁的氧化物有三种,其中Fe3O4是一种具有_____的黑色晶体,俗称磁性氧化铁.Fe2O3的用途________(举一例)。
(3)氢氧化铝其有两性,写出氢氧化铝分别溶于强酸和强碱的离子方程式_____,_______。
(4)在抗震救灾中要用到大量漂白粉和漂白液杀菌消毒,漂白粉的制取过程如下:通过煅烧石灰石得到生石灰,生石灰溶于水得石灰乳,在向石灰乳中通入氯气反应得漂白粉,有关的反应化学方程式为:CaCO3![]() CaO+CO2↑_________、_________。
CaO+CO2↑_________、_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com