
【题目】化学方程式为3MnO2+6KOH+KClO3![]() 3K2MnO4+KCl+3H2O,下列说法中正确的( )
3K2MnO4+KCl+3H2O,下列说法中正确的( )
A. 反应中MnO2是氧化剂 B. 该反应属于复分解反应
C. KClO3在反应中失去电子 D. 反应中每生成lmol K2MnO4,氧化剂得到2mol电子
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:

请回答下列问题:
(1)沉淀B的成分是____________(填化学式,下同);
(2)沉淀C的成分是__________;
(3)沉淀F转化为物质M的化学方程式为__________;
(4)由物质M制取铝的化学方程式为____________________;
(5)溶液D中通入过量CO2生成沉淀F的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体在有机合成、无机合成等方面有着重要应用。咪唑是合成“离子液体”的一种原料,其结构如图所示。下列有关咪唑说法不正确的是
![]()
A. 化学式C3H4N2
B. 分子中含有一种非极性键和两种极性键
C. 可以发生取代、加成、氧化反应
D. 一氯取代物的同分异构体共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某物质X 能发生如图转化(四种物质均含元素R ) ,回答下列问题:
![]()
Ⅰ.已知X是一种能使湿润的红色石蕊试纸变蓝的气体,与A化合生成一种正盐,则:
(1)X的电子式为______,写出X与Z在催化剂作用下生成两种无毒物质的化学方程式_____。
(2)在含Cu2+离子溶液中,RO2-离子可转化为RO,写出Cu+和RO2-离子在酸性水溶液中反应的离子方程式___________。
Ⅱ.若X的产量是衡量一个国家石油化工水平的标志,且Y与A在浓硫酸作用下生成一种具有香味的物质B, 则:
(1)X的分子式为________,①的反应类型是_______,工业上以X为为原料可以合成一种生活中最常见的有机高分子材料,其反应的化学方程式为__________。
(2)实验室利用Y与A制备B,写出化学反应方程式:________,实验中配制一定比例的Y、A和浓硫酸的混合液的方法(加入试剂的顺序)是:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛性能优越,被称为继铁、铝之后的“第三金属”,工业上用钛矿石(主要成分:FeO、TiO2,SiO2等)为原料制取钛,工艺流程如下,回答下列问题:

已知:TiO2(s)+H2SO4(aq)=TiOSO4(aq)+H2O
(1)钛矿石在加入浓硫酸酸溶前要先粉碎,其目的是__________。
(2)操作1名称为_______,固体2的主要成分是______, 写出金属钠与TiCl4共热的化学反应方程式_________________。
(3)一定温度下,在一个固定容积的容器中发生反应:TiO2(s)+2Cl2(g)+2C(s)![]() TiCl4(g)+2CO(g),反应中氧化剂是________,下列说法能够说明该反应已达化学平衡状态的是_________________。
TiCl4(g)+2CO(g),反应中氧化剂是________,下列说法能够说明该反应已达化学平衡状态的是_________________。
A.反应每断裂2个Cl一Cl键,同时生成2 个C![]() O键
O键
B. 容器内压强不再发生变化
C. Cl2和TiCl4的浓度不再变化
D.v(TiCl4)正=2v(C)逆
(4)将50吨钛矿石经上述变化后,最终可得金属钛12吨,假设各步反应均完全,则原矿石中TiO2的百分含量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33℃、沸点为114℃。
2H++SnO22-![]() Sn(OH)2
Sn(OH)2![]() Sn2++2OH-
Sn2++2OH-
请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为_______。
(2)用于微电子器件生产的锡粉纯度测定:
① 取1.19g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
② 加入过量的Fe2(SO4)3;③ 用0.1000 mol/LK2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。
步骤② 中加入Fe2(SO4)3的作用是_______;此锡粉样品中锡的质量分数________。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如图所示:

① 步骤I加入Sn粉的作用:___________及调节溶液pH。
② 步骤Ⅲ生成SnO的离子方程式:____________________。
③ 以锡单质为阳极,铁片为阴极,SnSO4溶液为电解质溶液,在铁片上镀锡,阴极反应式是____________,镀锡铁破损后在潮湿的环境中容易发生腐蚀的原因是_________,若是在较弱的酸性环境中发生腐蚀,正极反应式是____________。
(4)SnCl4蒸气遇水汽呈浓烟状,因而叮制作烟幕弹, 其反应的化学方程式为___________。
(5)锡的+2价化合物应具有较强的还原性,已知Sn2+的还原性比 Fe2+的还原性强,PbO2的氧化性比Cl2的氧化性强。试写出下列反应的化学方程式:
① 将SnCl4溶液蒸干灼烧得到的固体物质是________;
② 若用SnCl2溶液与过量的碱溶液反应制Sn(OH)2,该碱溶液可选用________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题.

(1)该浓盐酸中HCl的物质的量浓度为 ______ molL-1.
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是______ .
A.溶液中HCl的物质的量
B.溶液的浓度
C.溶液中Cl-的数目
D.溶液的密度
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次并在操作步骤空白处填上适当仪器名称) ______ .
A.用30mL水洗涤 ______ 2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用 ______ 加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
(4)在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括 号内填“偏大”,“偏小”,或“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面 ______
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。请回答下列问题:
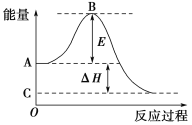
(1)图中A点表示:________________________________________;
C点表示:________________。E的大小对该反应的反应热________(填“有”或“无”)影响。
(2)图中ΔH=________kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下利说法正确的是(NA表示阿伏加德罗常数的值)
①28g氮气所含有的原子数目为NA
②4g金属钙变成钙离子时失去的电子数目为0.1 NA
③在常温常压下,11.2LN2含有含有的分子数为0.5NA
④在标况下,1 molNe含有的原子数为NA
⑤0.5 mol单质铝与足量盐酸反应转移电子数为1.5NA
⑥标准状况下,1 L水所含分子数为1 /22.4NA
⑦17g氨气所含电子数目为10NA
A. ①②⑤⑥⑦ B. ①②④⑤⑥ C. ⑤⑦ D. ④⑤⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com