
【题目】下利说法正确的是(NA表示阿伏加德罗常数的值)
①28g氮气所含有的原子数目为NA
②4g金属钙变成钙离子时失去的电子数目为0.1 NA
③在常温常压下,11.2LN2含有含有的分子数为0.5NA
④在标况下,1 molNe含有的原子数为NA
⑤0.5 mol单质铝与足量盐酸反应转移电子数为1.5NA
⑥标准状况下,1 L水所含分子数为1 /22.4NA
⑦17g氨气所含电子数目为10NA
A. ①②⑤⑥⑦ B. ①②④⑤⑥ C. ⑤⑦ D. ④⑤⑦
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】化学方程式为3MnO2+6KOH+KClO3![]() 3K2MnO4+KCl+3H2O,下列说法中正确的( )
3K2MnO4+KCl+3H2O,下列说法中正确的( )
A. 反应中MnO2是氧化剂 B. 该反应属于复分解反应
C. KClO3在反应中失去电子 D. 反应中每生成lmol K2MnO4,氧化剂得到2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素的原子间在形成化合物时容易形成共价键的是
原子 | a | b | c | d | e | f | g |
M层电子数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
A. a和c B. a和f
C. d和g D. b和g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是最普通、最常见的物质之一。
(1)“水”有很多种。下列“水”属于纯净物的是 ________ (填字母序号)。
A.河水 B.自来水 C.矿泉水 D.蒸馏水
(2)电解水可证明水由氢、氧两种元素组成,该反应的化学方程式为________ 。
(3)水是重要的溶剂和化工原料。氯碱工业以饱和食盐水为原料获得烧碱等化工产品,反应原理为:![]() 。
。
①20℃时,NaCl 的溶解度是36 g。该温度下,饱和食盐水中溶质与溶剂的质量比为______。
②烧碱可用于处理硫酸泄漏,反应的化学方程式为__________。
(4)水在化学实验中具有重要作用。将铁丝放在潮湿的空气中(如下图所示),一段时间后,观察到导管内液面下降,导管口有气泡冒出,关闭 K。请解释导管内液面上升和下降的原因:___________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高三一年的化学复习,学生要抓住两方面,一方面是教材,另一方面是历年的高考真题。每年的高考题,在教材中几乎都能找到影子,所以同学们一定要紧紧抓住教材,根据《必修一》第三章和第四章的内容回答下列问题:
(1)实验3-1是取用钠单质的实验,用品有小刀,_____、_____、培养皿。
(2)铁是人类应用最广泛,铁的氧化物有三种,其中Fe3O4是一种具有_____的黑色晶体,俗称磁性氧化铁.Fe2O3的用途________(举一例)。
(3)氢氧化铝其有两性,写出氢氧化铝分别溶于强酸和强碱的离子方程式_____,_______。
(4)在抗震救灾中要用到大量漂白粉和漂白液杀菌消毒,漂白粉的制取过程如下:通过煅烧石灰石得到生石灰,生石灰溶于水得石灰乳,在向石灰乳中通入氯气反应得漂白粉,有关的反应化学方程式为:CaCO3![]() CaO+CO2↑_________、_________。
CaO+CO2↑_________、_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】8.8g FeS与400mL 1 mol/L硝酸溶液恰好完全反应,反应后产物为Fe2(SO4)3和Fe(NO3)3, X、H2O,则X为
A. N2 B. N2O C. NO D. NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按构造原理写出第9、17、35号元素原子的电子排布式。它们的核外电子分别有几层?______________最外层电子数分别为多少?______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与科技、社会、生产、生活等关系密切,下列有关说法不正确的是( )
A.部分卤代烃可用作灭火剂
B.福尔马林(甲醛溶液)可用于浸泡生肉及海产品以防腐保鲜
C.提倡人们购物时不用塑料袋,是为了防止白色污染
D.石油分馏是物理变化,可得到汽油、煤油和柴油等产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入5 mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如下图所示:
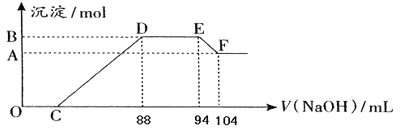
(1)B与A的差值为________mol。
(2)C点对应的溶液体积为________mL。
(3)原硝酸溶液中含硝酸的物质的量为________mol。
(4)铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为_______________。
(5)写出铝与该浓度硝酸反应的离子方程式_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com