
【题目】乳酸是天然的酸味调节剂,乳酸的结构简式为![]() ,下列关于乳酸的说法正确的是( )
,下列关于乳酸的说法正确的是( )
A.含有醛基官能团
B.1mol乳酸可以和2molNaOH 溶液恰好完全反应
C.1mol乳酸和碳酸氢钠溶液充分反应生成2molCO2
D.乳酸和乙酸都显酸性,但它们在浓硫酸作用下经加热可以发生化学反应。
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2和Zn是制造普通干电池的重要原料,现用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制备MnO2和Zn的工艺流程如图:
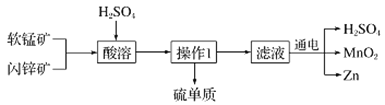
下列说法不正确的是( )
A.干电池是一种将化学能转变为电能的装置
B.酸溶时,ZnS作还原剂,每析出12.8gS沉淀,共转移0.8mol电子
C.通电电解时MnO2在阳极处生成,电极反应为:Mn2+-2e-+2H2O═MnO2+4H+
D.原料硫酸可以循环使用,且可用盐酸代替硫酸进行酸溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物在工农业生产和人类生活中有着重要的作用。回答下列问题:
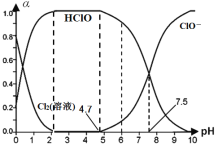
(1)25℃时将氯气溶于水形成“氯气-氯水”体系,该体系存在多个含氯元素的平衡关系,其中之一为:Cl2(溶液)+H2O![]() HClO+H++Cl-,体系中Cl2(溶液)、HClO和ClO-三者的物质的量分数(α)随pH(酸碱度)变化的关系如图所示。已知HClO的杀菌能力比ClO-强,用氯气处理饮用水时,杀菌效果最强的pH范围为__(填字母)。
HClO+H++Cl-,体系中Cl2(溶液)、HClO和ClO-三者的物质的量分数(α)随pH(酸碱度)变化的关系如图所示。已知HClO的杀菌能力比ClO-强,用氯气处理饮用水时,杀菌效果最强的pH范围为__(填字母)。
A.0~2 B.2~4.7 C.4.7~7.5 D.7.5~10
(2)写出次氯酸光照分解的化学方程式___,如果在家中直接使用自来水养金鱼,除去其中残留的次氯酸可采取的简易措施为__。
(3)NaClO、NaClO2、ClO2等含氯化合物都是常见的消毒剂,这是因为它们都具有强氧化性。
①写出工业上用氯气和NaOH溶液生产消毒剂NaClO的化学方程式___;
②84消毒液(主要成分是NaClO)与洁厕灵(主要成分是盐酸)混在一起使用会产生有毒气体Cl2,其反应的离子方程式为__;
③NaClO2中Cl元素化合价为__;
④ClO2的杀菌效果比Cl2好,等物质的量的ClO2杀菌效果是Cl2的__倍(杀菌效果与单位物质的量的氧化剂得电子的物质的量有关,ClO2与Cl2消毒杀菌后均被还原为Cl-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.铜和过量的浓HNO3反应:3Cu +8H+ +2NO![]() = 3Cu2++ 2NO↑+4H2O
= 3Cu2++ 2NO↑+4H2O
B.CaCO3和盐酸反应:2H++CaCO3 =Ca2+ +CO2 ↑+H2O
C.向NH4HCO3溶液中加过量Ca(OH)2溶液并加热:NH![]() +OH-
+OH-![]() NH3↑+H2O
NH3↑+H2O
D.将Ba(OH)2滴加到稀硫酸中:Ba2+ + SO![]() = BaSO4 ↓
= BaSO4 ↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医药阿斯匹林的结构简式如图。试回答:
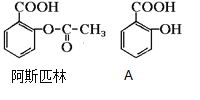
(1)阿斯匹林可看成酯类物质,口服后在胃肠作用下,阿斯匹林发生水解反应,生成A和B两种产物。其中A的结构简式如图,则阿斯匹林的分子式为:____________,B的结构简式为:_______,B中的官能团是:____________(名称)。
(2)上述水解产物B与甲醇、浓硫酸共热反应的化学方程式为:____________。
(3)甲醇在铜作催化剂时与氧气反应的化学方程式为:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。某温度下,将2molSO2和1molO2置于10L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g) ΔH<0。某温度下,将2molSO2和1molO2置于10L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
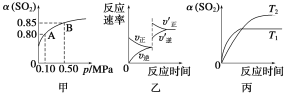
A.由图甲知,A点SO2的平衡浓度为0.08mol·L-1
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2
C.达到平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示
D.压强为0.50MPa时不同温度下SO2的转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容的密闭容器中进行反应 A(g)═B(g)+C(g),若反应物的浓度由2molL-1 降到 0.8molL-1 需要 20s,那么反应物浓度再由 0.8molL-1 降到 0.2molL-1 所需要的时间为
A.10sB.大于 10sC.小于 10sD.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气作为新能源,广泛应用于能源、化学等领域。现阶段氢气主要通过天然气重整的方式进行工业生产。发生的化学方程式如下:
反应I CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206 kJ/mol
CO(g)+3H2(g) △H1=+206 kJ/mol
反应II CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41 kJ/mol
CO2(g)+H2(g) △H2=-41 kJ/mol
副反应 CH4(g)![]() C(s)+2H2(g) △H3=+75 kJ/mol
C(s)+2H2(g) △H3=+75 kJ/mol
(1)①若仅发生反应I,为提高CH4的平衡转化率,宜采用的反应条件为_________。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
②某研究小组在一定条件下往恒温恒容的密闭容器中通入一定量的甲烷和水蒸气,实验过程中发现CO2的产率远大于CO的产率,请解释可能的原因________________。
(2)在实际生产过程中,科学家发现使用Ni作为催化剂(当Ni表面吸附大量碳时,会导致催化剂活性下降),可加快反应I的反应速率,从而加快整个反应的进行,提高单位时间内H2的产率。
①某恒容体系中,压强为1.3MPa,水/甲烷的物质的量之比为4,反应相同时间,H2的物质的量随反应温度的变化曲线如图所示。
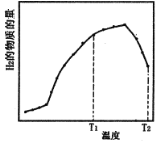
下列说法正确的是__________
A.对反应I而言,KT1>KT2
B.水/甲烷的物质的量之比等于4,大于初始反应的化学计量数之比,有利于促进CH4的转化,同时也有利于CO转化为CO2
C.使用Ni做催化剂,可增加活化分子百分数,从而加快反应速率,其主要原因是提高分子自身所具有的能量
D.若控制其他条件不变,缩小体积,则CH4的平衡转化率将减小
②在某恒温体系中,体积为1L,水/甲烷的物质的量之比等于4,投入CH4的量为l mol,若仅发生上述一系列反应,一段时间后,测得CH4的转化率为a,其中生成CO的选择性(转化的CH4中,生成CO的百分含量)为b,CO2的浓度为c mol/L,求此时H2的物质的量浓度为___________,CO的物质的量浓度为______________
(3)现科学家发现,以Ni-CaO为复合催化剂能在一定程度上促进天然气重整反应的正向进行,使H2体积分数达到95%左右。请从能量利用及平衡移动角度,理论分析以Ni-CaO为复合催化剂的优点_____________________________________________。
(4)CH4自身也可做为然料电池的原料,其工作原理如图所示。
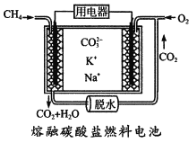
请写出通入甲烷-极的电极反应式为_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com