
【题目】钾(K)资源丰富,成本低廉,用其制作的钾离子电池有着超越锂离子电池的发展前景。我国科研人员在钾离子电池的研发上做出了巨大的贡献。如图是我国某科研团队研制的一种钾离子电池充电时的示意图,下列说法不正确的是( )
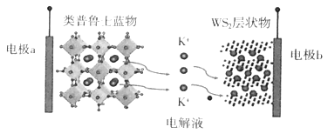
A.放电时,外电路电子由电极a流向电极b
B.钾离子电池电解液一般选择有机溶剂,但会有一定的安全隐患
C.充电时,每当外电路中转移1mole-,正极材料会“释放”39gK+
D.充电时,电极b上的电极反应式为:WS2+xK++xe-=KxWS2
【答案】A
【解析】
该电池充电过程中,K+由类普鲁士蓝物移向WS2层状物中,由此可知,电极a发生氧化反应,电极b发生还原反应,充电过程中,电极a为阳极,电极b为阴极,放电过程中,电极a为正极,电极b为负极,以此解答。
A.由上述分析可知,放电时,电极b为负极,发生氧化反应,电极a为正极,发生还原反应,因此外电路电子由电极b流向电极a,故A符合题意;
B.钾离子电池电解液基本沿用锂离子电池电解液体系,钾盐主要有六氟磷酸钾(KPF6)、双氟磺酰亚胺钾(KFSI)等,常见的溶剂有碳酸乙烯酯(EC)、碳酸丙烯酯(PC)、碳酸二乙酯(DEC)、碳酸二甲酯(DMC)等,其有机易燃电解质在循环过程中会带来安全威胁,热失控的可能性被认为是引起安全问题的主要问题,故B不符合题意;
C.充电时,原正极材料发生氧化反应“释放”K+,K+带1个单位正电荷,每当外电路中转移1mole-,正极材料会“释放”1molK+(即39gK+),故C不符合题意;
D.充电时,电极b为阴极,WS2发生还原反应,电极反应式为:WS2+xK++xe-=KxWS2,故D不符合题意;
故答案为:A。


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到目的是
A.用萃取的方法分离煤油和汽油
B.用水鉴别苯、四氯化碳、乙醇三种无色液体
C.用如图装置验证Na和水反应是否为放热反应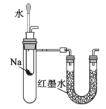
D.棉织品与丝织品可以用灼烧法进行鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是化学实验室中最常见的有机物,它易溶于水并有特殊香味;B的产量可以衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示部分反应条件、产物省略:
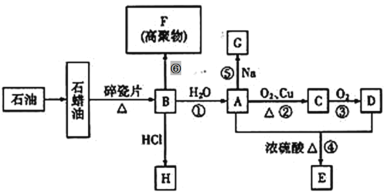
回答下列问题:
(1)工业上由石蜡油获得B的方法称为___________。
(2)①决定化合物A的化学特性的原子团的名称为___________。
②B到A的反应类型为___________,A到E的反应类型为___________。
(3)写出下列反应的化学方程式。
反应②:___________
反应⑥:___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到相应目的的是
A | B | C | D | |
目的 | 比较碳酸根与碳酸氢根水解程度 | 研究浓度对化学平衡的影响 | 比较不同催化剂对化学反应速率的影响 | 比较碳酸、醋酸和硼酸的酸性强弱 |
实验方案 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g) +O2(g)=2H2O(g) ΔH =-483.6 kJmol-1
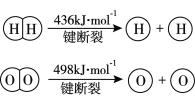
下列说法不正确的是
A. 该反应可作为氢氧燃料电池的反应原理
B. 破坏1mol H-O键需要的能量是463.4 kJ
C. H2O(g)=H2(g) +1/2O2(g) ΔH = +241.8 kJmol-1
D. H2(g)中的H-H键比H2O(g)中的H-O键牢固
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低浓度的氢氟酸是一元弱酸,存在下列两个平衡:HF![]() H++F-,HF+F-
H++F-,HF+F-![]() HF2- (较稳定)。25℃时,不同酸性条件下的2.0amol·L-1HF溶液中,c(HF)、c(F-)与溶液pH(忽略体积变化)的变化关系如图所示。下列说法正确的是( )
HF2- (较稳定)。25℃时,不同酸性条件下的2.0amol·L-1HF溶液中,c(HF)、c(F-)与溶液pH(忽略体积变化)的变化关系如图所示。下列说法正确的是( )
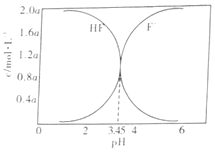
A.c(HF)+c(F-)=2.0amol·L-1
B.c(F-)>c(HF)时,溶液一定呈碱性
C.随着溶液pH增大,![]() 不断增大
不断增大
D.25℃时,HF的电离常数Ka=10-3.45
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是2SO3(g)![]() 2SO2(g)+O2(g)的能量变化图,据图得出的相关叙述正确的是( )
2SO2(g)+O2(g)的能量变化图,据图得出的相关叙述正确的是( )
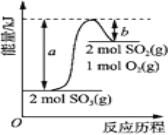
A. 该化学反应过程中既有能量的吸收又有能量的释放
B. 2SO3(g)![]() 2SO2(g)+O2(g) △H=-(a-b) kJ/mol
2SO2(g)+O2(g) △H=-(a-b) kJ/mol
C. 1 mol SO2的能量比1 mol SO3的能量高
D. 若某容器内有2 mol SO3充分反应,吸收(a-b) kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设反应①Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应②Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应②Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。测得在不同温度下,K1、K2值如下:
FeO(s)+H2(g)的平衡常数为K2。测得在不同温度下,K1、K2值如下:
温度/℃ | K1 | K2 |
500 | 1.00 | 3.15 |
700 | 1.47 | 2.26 |
900 | 2.40 | 1.60 |
(1)若500 ℃时进行反应①,CO2的转化率为_______________。
(2)900 ℃时进行反应③H2(g)+CO2(g)![]() H2O(g)+CO(g),其平衡常数K3=______________。
H2O(g)+CO(g),其平衡常数K3=______________。
(3)反应②的焓变ΔH____________(填“>”、“<”或“=”)0。
(4)700 ℃时反应②达到化学平衡,要使该平衡向正反应方向移动,当其他条件不变时,可采取的措施有___________________________________。
A.缩小容器容积 B.加入更多的水蒸气
C.升高温度至900 ℃ D.使用合适的催化剂
(5)下列图像符合反应①的是________________________。
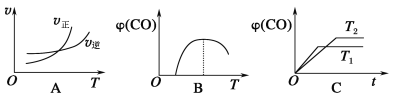
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含苯酚的工业废水的处理流程如图所示。

(1)①流程图设备Ⅰ中进行的是操作________(填写操作名称)。实验室里这一步操作可以用_______(填仪器名称)进行。
②由设备Ⅱ进入设备Ⅲ的物质A是______________(填化学式,下同)。由设备Ⅲ进入设备Ⅳ的物质B是___________。
③在设备Ⅲ中发生反应的化学方程式为_____________________。
④在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和______。通过 _________________(填操作名称)操作,可以使产物相互分离。
⑤图中,能循环使用的物质是_______、_____________C6H6和CaO。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是____________。
从废水中回收苯酚的方法是①用有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚与有机溶剂脱离;③加入某物质又析出苯酚。试写出②、③两步的反应方程式:_________________________。
(3)为测定废水中苯酚的含量,取此废水100 mL,向其中加入浓溴水至不再产生沉淀为止,得到沉淀0.331 g,求此废水中苯酚的含量____________(mg·L-1)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com