
分析 (1)依据方程式可知反应时加入氢氧化钙是为了提高双氧水的利用率;
(2)过氧化钙与水反应生成氢氧化钙、氧气和水,因此箱池水塘中加入一定量的CaO2•8H2O,池塘水中浓度增加的离子有钙离子和氢氧根离子;
(3)①O2将Mn2+氧化成MnO(OH)2的反应中O2是氧化剂得到4个电子,Mn元素的化合价从+2价升高到+4价,失2个电子,所以根据电子得失守恒以及原子守恒可知反应的离子方程式为:O2+2Mn2++4OH-=MnO(OH)2;
②依据流程图并依据电子得失守恒可知氧气得到的电子就是硫代硫酸钠失去的电子,其中硫元素化合价从+2价升高到+2.5价,计算该水样中的溶解氧.
解答 解:(1)依据方程式Ca(OH)2+H2O2+6H2O═CaO2•8H2O可知,反应时加入氢氧化钙是为提高H2O2的利用率,
故答案为:提高H2O2的利用率;
(2)过氧化钙与水反应生成氢氧化钙、氧气和水,因此箱池水塘中加入一定量的CaO2•8H2O,池塘水中浓度增加的离子有钙离子和氢氧根离子,选择AD,
故答案为:AD;
(3)①O2将Mn2+氧化成MnO(OH)2的反应中O2是氧化剂得到4个电子,Mn元素的化合价从+2价升高到+4价,失2个电子,所以根据电子得失守恒以及原子守恒可知反应的离子方程式为:O2+2Mn2++4OH-=2MnO(OH)2,
故答案为:O2+2Mn2++4OH-=2MnO(OH)2;
②I2+2S2O32-=2I-+S4O62-,
n(I2)=$\frac{c(N{a}_{2}{S}_{2}{O}_{3})•V(N{a}_{2}{S}_{2}{O}_{3})}{2}$=$\frac{0.1000mol/L×13.50mL×1{0}^{-3}L/mol}{2}$=6.750×10-5mol,
n(MnO(OH)2)=n(I2)=6.750×10-5mol,
n(O2)=$\frac{1}{2}$n(MnO(OH)2)=$\frac{1}{2}$×6.750×10-5mol=3.375×10-5mol,
水中溶解氧=$\frac{{3.375×{{10}^{-5}}mol×32g/mol×1000mg/g}}{{100.00mL×{{10}^{-3}}L/mL}}$=10.80mg/L,故答案为:10.80mg/L.
点评 本题考查氧化还原反应方程式书写以及溶解氧含量测定等,主要是滴定实验过程的理解应用和计算分析,掌握基础是解题关键,题目难度中等.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:选择题

| A. | 反应①中(C6H10O5)n可表示淀粉或纤维素 | |
| B. | 反应②属于氧化反应 | |
| C. | 将在空气中灼烧后的铜丝趁热插入乙醇中可得到乙酸 | |
| D. | 反应③得到的乙酸乙酯中含有乙醇和乙酸,可用饱和氢氧化钠溶液除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
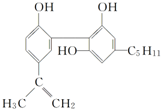 我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构简式如图:
我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构简式如图:| A. | 它的化学式为C20H24O3 | |
| B. | 从结构上看,它属于酚类 | |
| C. | 从结构上看,它属于醇类 | |
| D. | 从元素组成上看,它可以在氧气中燃烧生成CO2和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH3的生成速率与NH3的分解速率相等 | |
| B. | 单位时间内生成amolN2同时消耗3amolH2 | |
| C. | 单位时间内生成amolN2同时消耗amolH2 | |
| D. | 单位时间内生成1molN≡N断裂同时有3molH-H合成 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
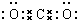 ;元素Z的离子结构示意图为
;元素Z的离子结构示意图为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com