
【题目】下表是元素周期表的一部分,阅读表格回答问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
一 | ① | |||||||
二 | ② | ③ | ④ | |||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)元素③的原子序数为___________,被选做相对原子质量标准的核素是___________(填核素符号);
(2)①与②、③、④、⑦、⑧形成的化合物中,最稳定的是___________(填化学式);表中所示元素最高价氧化物对应的水化物中酸性最强的是___________(填化学式);
(3)请画出元素④与⑤按原子个数比1︰1组成的淡黄色固体物质的化学式___________;
(4)请写出⑤的最高价氧化物对应水化物与⑥的单质反应的离子方程式___________。
【答案】7 12C H2O HClO4 Na2O2 2Al+2OH-+2H2O=2![]() +3H2↑
+3H2↑
【解析】
根据元素周期表结构可知,①为氢元素,②为碳元素,③为氮元素,④为氧元素,⑤为钠元素,⑥为铝元素,⑦为磷元素,⑧为硫元素,⑨为氯元素。
(1)③为氮元素,原子序数为7,被选做相对原子质量标准的核素是12C;
(2)①与②、③、④、⑦、⑧形成的化合物中,氢化物的稳定性与非金属性有关,最稳定的是H2O;表中所示元素最高价氧化物对应的水化物中酸性与非金属性有关,同周期,从左到右,非金属性增强,同主族,从上到下,非金属性减弱,故最强的是HClO4;
(3)元素④与⑤按原子个数比1︰1组成的淡黄色固体物质的化学式Na2O2;
(4)⑤的最高价氧化物对应水化物为氢氧化钠,⑥的单质是铝,反应的离子方程式2Al+2OH-+2H2O=2![]() +3H2↑。
+3H2↑。


 核心素养学练评系列答案
核心素养学练评系列答案科目:高中化学 来源: 题型:
【题目】把 4.6g的Na放入足量的水中,至充分完全反应。 请写出计算过程:
(1)写出化学方程式,画出双线桥。_____________________
(2)该反应电子转移的物质的量。________________________
(3)生成的 H2 在标准状况下的体积。_____________________
(4)反应后溶液体积为2L,计算所得溶液的物质的量浓度。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型(如图),据此回答下列问题:
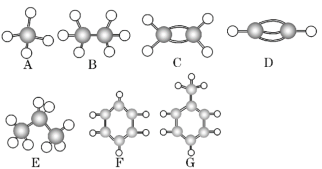
(1)常温下含氢量最高的气态烃是________(填字母)。
(2)能够使酸性高锰酸钾溶液褪色的烃有________种。
(3)写出F发生硝化反应的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种化合物(如图)由W、X、Y、Z四种短周期元素组成,其中W、Y、Z分别位于三个不同周期,Y核外最外层电子数是W核外最外层电子数的二倍;W、X、Y三种简单离子的核外电子排布相同。下列说法错误的是
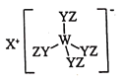
A.原子半径:![]()
B.简单离子的氧化性:![]()
C.X与Y、Y与Z均可形成具有漂白性的化合物
D.W与X的最高价氧化物的水化物可相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将VmLNO和NO2的混合气体通过水吸收后,得到amL无色气体A。将此无色气体A与等体积的O2混合,再通过水充分吸收后,收集到4mL无色气体B。试回答:
(1)气体A是___;气体B是___。
(2)A气体的体积是___毫升。
(3)V的取值范围是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A.11g超重水(T2O)含中子数为5NA
B.1mol SiO2中Si—O键的数目为4NA
C.常温下,pH=6的MgCl2溶液中H+的数目为10-6 NA
D.标准状况下,2.24L Cl2全部溶于水所得溶液中的Cl-数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.醋酸与氢氧化钠溶液反应:CH3COOH+OH-=CH3COO-+H2O
B.铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
C.氯化铝溶液与氨水反应:Al3++4OH-=AlO![]() +2H2O
+2H2O
D.碳酸钠溶液与稀盐酸的反应:Na2CO3+2H+=CO2↑+H2O+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物丙可由如图反应得到,则丙的结构不可能是
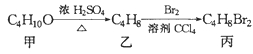
A. CH3CBr2CH2CH3B. (CH3)CBrCH2Br
C. CH3CH2CHBrCH2BrD. CH3(CHBr)2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组的同学运用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:
(1)用分析天平准确称取该样品5.360g,全部溶于水配制成1000.0mL的溶液。用碱式滴定管取其中20.00mL放在锥形瓶中,滴加几滴甲基橙做指示剂。用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视着____。滴定终点的现象是____________。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_____(填写序号)
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则滴定终点的读数为____mL。

(4)某学生根据三次实验分别记录有关数据如下:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | |||
第1次 | 20.00 | 0.00 | 26.01 | |
第2次 | 20.00 | 1.56 | 30.30 | |
第3次 | 20.00 | 0.22 | 26.21 | |
请选用其中合理的数据列式计算出该样品中NaOH的质量百分含量。(写出计算过程)__
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com