
氢氧两种元素形成的常见物质有H2O与H2O2,在一定条件下均可分解。
(1)已知:
|
化学键 |
断开1mol化学键所需的能量(kJ) |
|
H—H |
436 |
|
O—H |
463 |
|
O=O |
498 |
①H2O的电子式是 。
②H2O(g)分解的热化学方程式是 。
③11.2 L(标准状况)的H2完全燃烧,生成气态水,放出 kJ的热量。
(2)某同学以H2O2分解为例,探究浓度与溶液酸碱性对反应速率的影响。常温下,按照如表所示的方案完成实验。
|
实验编号 |
反应物 |
催化剂 |
|
|
a |
50 mL 5% H2O2溶液 |
|
1 mL 0.1 mol·L-1 FeCl3溶液 |
|
b |
50 mL 5% H2O2溶液 |
少量浓盐酸 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
|
c |
50 mL 5% H2O2溶液 |
少量浓NaOH溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
|
d |
50 mL 5% H2O2溶液 |
|
MnO2 |
①测得实验a、b、c中生成氧气的体积随时间变化的关系如图1所示。

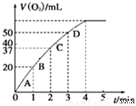
图1 图2
由该图能够得出的实验结论是_________。
②测得实验d在标准状况下放出氧气的体积随时间变化的关系如图2所示。解释反应速率变化的原因: 。
(1)① ②+482 kJ·mol-1③120.5
kJ.;⑵①其他条件不变,在碱性环境下加快H2O2的分解速率,酸性环境下减缓H2O2的分解速率;②随着反应的进行H2O2的浓度逐渐减少,H2O2的分解速率逐渐减慢。
②+482 kJ·mol-1③120.5
kJ.;⑵①其他条件不变,在碱性环境下加快H2O2的分解速率,酸性环境下减缓H2O2的分解速率;②随着反应的进行H2O2的浓度逐渐减少,H2O2的分解速率逐渐减慢。
【解析】
试题分析:(1)①双氧水是一种含有氧氧共价键和氧氢共价键的极性分子,电子式为: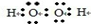
② 断裂化学键吸收能量、形成化学键放出能量,根据水分解化学方程:2H2O(g)=2H2(g)+2O2(g)可知:2molH2O含有4mol O—H,则断裂需要吸收的能量为463 kJ·mol-1×4mol=1852KJ,形成2 mol H—H和1 mol O=O释放的能量之和为:(436 kJ·mol-1×2mol)+498 kJ·mol-1×1mol=1370KJ;1852KJ>1370KJ,当断裂化学键吸收的能量大于形成化学键吸收的能量时,反应吸热,该反应吸收的热量为:1852KJ-1370KJ=+482 kJ,所以该反应的热化学方程式为:2H2O(g)=2H2(g)+2O2(g) △H=+482 kJ·mol-1
③根据热化学方程式计算式可以进行逆运算的原理,将②中2H2O(g)=2H2(g)+2O2(g) △H=+482 kJ·mol-1
热化学方程式颠倒后得到:2H2(g)+2O2(g) =2H2O(g)△H=-482
kJ·mol-1,然后将11.2LH2转化为0.5mol,再依据刚得到的H2燃烧的热化学方程式进行计算得出11.2L H2完全燃烧时放出的热量为: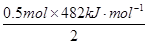 =120.5 kJ.
=120.5 kJ.
⑵①结合函数图像可知,曲线C最先出现拐点,所用的时间少,而曲线b出现拐点较晚,所用的时间长,由此可知,在其他条件不变时,在碱性环境下加快H2O2的分解速率,酸性环境下减缓H2O2的分解速率。
②随着反应的进行H2O2的浓度逐渐减少,H2O2的分解速率逐渐减慢。
考点:考查电子式、从化学键发生变化的角度书写热化学方程、应用盖斯定律考查反应热的计算、化学反应速率及其影响因素。


科目:高中化学 来源: 题型:阅读理解
 (2009?宿迁二模)聚合铁(简称PFS)化学式为:[Fe2(OH)n(SO4) 3-
(2009?宿迁二模)聚合铁(简称PFS)化学式为:[Fe2(OH)n(SO4) 3-| n | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||








查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂。E有“生物金属”之称,E![]() 离子和氩原子的核外电子排布相同。
离子和氩原子的核外电子排布相同。
请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的基态原子的外围电子排布式为 。
 (2)下列叙述正确的是 。(填字母)
(2)下列叙述正确的是 。(填字母)
a.M与水分子间能形成氢键,N是非极性分子
b.M和二氧化碳分子中的中心原子均采用sp2杂化
c.N分子中含有6个![]() 键和1个
键和1个![]() 键
键
d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
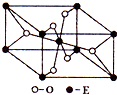
(3)E的一种氧化物Q,其晶胞结构如右上图所示,则Q的化学式为 ,该晶体中氧的配位数为 。
(4)电镀厂排放的废水中常含有剧毒的BC![]() 离子,可在Q的催化下,先用NaClO将 BC
离子,可在Q的催化下,先用NaClO将 BC![]() 氧化成BCD
氧化成BCD![]() ,再在酸性条件下BCD
,再在酸性条件下BCD![]() 继续被NaClO氧化成C2和BD2。
继续被NaClO氧化成C2和BD2。
① A、B、C、D四种元素的电负性由小到大的顺序为 。
② 与BCD![]() 互为等电子体的分子、离子的化学式依次为 (各写1种)。
互为等电子体的分子、离子的化学式依次为 (各写1种)。
③ 上述反应中后一步反应的离子方程式是 。
(5)在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为ECl3?6H20的绿色晶体,该晶体中两舞更体的物质的量之比为1:5,则该配离子的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com