
【题目】下列属于含有共价键的化合物的是
A. N2 B. CaCl2 C. KF D. NaOH
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组通过实验发现钾和钠的性质相似,下列说法中能最好地解释这个事实的是( )
A.都是金属元素
B.原子半径相差不大
C.最外层电子数相同
D.最高化合价相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在关于下图所示的原电池中,正确的是
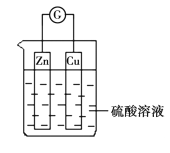
A. Zn被还原
B. 锌片上的电子经导线流向铜片
C. 该原电池运行一段时间后铜片的质量将增加
D. 该原电池将电能转变为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物甲有镇咳、镇静的功效,其合成路线如下:

已知: (R、R'、R"代表烃基或氢)
(R、R'、R"代表烃基或氢)
(1)有机物甲的分子式为___________,有机物A中含有的官能团的名称为_________________。
(2)有机物B的名称是____________,由B→D 所需的反应试剂和反应条件为_______________。
(3)在上述①~⑤反应中,属于取代反应的有____________(填序号)。
(4)写出E→F的化学方程式____________________________。
(5)写出同时满足下列条件的甲的同分异构体的结构简式________。
(Ⅰ)属于芳香族化合物 (Ⅱ)核磁共振氢谱上只有2组峰
(6)根据题给信息,写出以CH4为原料制备CH3CHO的合成路线(其他试剂任选)___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用下图装置进行制取乙酸乙酯的实验。
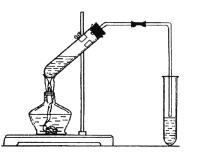
请回答下列问题:
(1)反应物中含有的官能团有____(填写名称)。
(2)实验室加入反应物和浓硫酸的先后顺序是____。
(3)浓硫酸在该反应中的作用是________。
(4)右边试管中的溶液是____,其作用是________。
(5)用同位素180示踪法确定反应原理(18O在CH3CH2OH中),写出能表示18O位置的化学方程式_______ ,反应类型是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铜的单质及它们的化合物与我们的生产、生活紧密相关。
(1)Cu处于周期表中______区,其最高能层的符号为______,基态铜原子的价电子排布式为________。
(2)向硫酸铜溶液中逐滴滴加氨水,首先形成蓝色沉淀,继续滴加氨水。沉淀溶解,得到深蓝色透明溶液,向深蓝色溶液中加入乙醇,析出深蓝色晶体。
①写出沉淀溶解,得到深蓝色透明溶液的离子方程式:________。
②为什么加入乙醇,能够析出深蓝色晶体?________________
③为什么NH3常在配合物中作配体,而NH4+却不能作配体?_______。
(3)Fe3+可以与SCN-、CN-、H2NCONH2(尿素)等多种配体形成很多的配合物。
①请写出一种与SCN-互为等电子体的分子:________。
②CN-的电子式为________。
③H2NCONH2(尿素)中N、C原子的杂化方式分别为_______、_______,组成尿素的4种元素的第一电离能由大到小的顺序为__________。
(4)某FeN,的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为________。
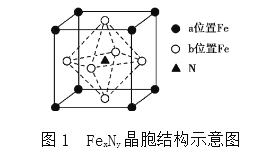
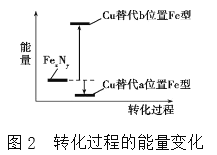
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步: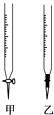
A.检查滴定管是否漏水
B.用蒸馏水洗干净滴定管
C.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
D.用待测定的溶液润洗酸式滴定管
E.用酸式滴定管取稀盐酸20.00mL,注入锥形瓶中,加入酚酞
F.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
G.另取锥形瓶,再重复操作一次
完成以下填空:
(1)操作F中应该选择图中 滴定管(填标号)。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
滴定终点溶液颜色的变化是 .若指示剂改为甲基橙则颜色的变化是 。
(3)滴定结果如表所示:
滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | ||
滴定前刻度 | 滴定后刻度 | |||
① | 20 | 1.02 | 21.03 | |
② | 20 | 2.00 | 25.00 | |
③ | 20 | 0.60 | 20.59 | |
滴定中误差较大的是第 次实验,造成这种误差的可能原因是 。
A.碱式滴定管在装液前未用标准NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D.达到滴定终点时,仰视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
(4)该盐酸的浓度为mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将20mL 0.5molL﹣1K2SO3溶液逐滴加入到20mL 0.2molL﹣1 硫酸酸化的紫色KMnO4溶液中,溶液恰好变为无色.则Mn元素在产物中的存在形态是( )
A.Mn
B.Mn2+
C.Mn2O3
D.K2MnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是( )
A. 该反应进行到第3分钟时,逆反应速率大于正反应速率
B. 若要提高SO2的转化率,可用空气代替纯氧气并鼓入过量空气
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com