
【题目】下列说法正确的是
A.形成离子键的阴阳离子间只存在静电吸引力
B.HF、HCl、HBr、HI的热稳定性和还原性均依次减弱
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘元素,在实验室中,我们可以用海带通过多步实验制成碘水,下列说法正确的是( )
A.该实验过程中要用到氧化剂
B.检验碘单质是否存在,可用碘化钾溶液
C.要萃取碘水中的碘,可以用汽油或酒精
D.利用如图所示装置不能分离食盐和晶体碘的混和物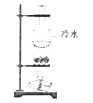
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:
2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
请回答下列问题:
(1)电极X的材料是;电解质溶液Y是;
(2)银电极为电池的极,X电极上发生的电极反应为;
(3)外电路中的电子是从电极流向电极.(填电极材料名称)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的叙述不正确的是
A. 淀粉水解可以制得葡萄糖
B. 碘酒可使细菌、病毒蛋白质变性而死亡
C. 氨基酸是两性化合物,能与酸或碱反应生成盐
D. 油脂均不能发生加成反应.但能在一定条件下发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组化合物中,化学键的类型完全相同的是( )
①CaCl2和Na2S ②Na2O和Na2O2 ③CO2和NH3 ④HCl和NaOH
A. ①②B. ①③C. ②③D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为M的气态化合物vL(标准状况),溶于mg水中,得到质量分数为w的溶液,物质的量浓度为cmolL﹣1 , 密度为ρgcm﹣3 , 则下列说法不正确的是( )
A.相对分子质量M= ![]()
B.物质的量浓度c= ![]()
C.质量分数w= ![]()
D.溶液密度ρ= ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z,W分别是HNO3、NH4NO3、NaOH,NaNO2四种强电解质中的一种.下表是常温下浓度均为0.01molL﹣1的X,Y,Z,W溶液的pH.
0.01mol/L的溶液 | X | Y | Z | W |
PH | 12 | 2 | 8.5 | 4.5 |
(1)X,W的化学式分别为、 .
(2)W的电离方程式为 .
(3)25℃时,Z溶液的pH>7的原因是(用离子方程式表示).
(4)将X,Y,Z各1molL﹣1同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为 .
(5)Z溶液与W溶液混合加热,可产生一种无色无味的单质气体,该反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的2p轨道上有2个未成对电子,Y元素原子的4p轨道上有3个未成对电子.X跟Y可形成化合物Y2X3 , Z元素可以形成正一价离子.请回答下列问题:
(1)X元素原子基态时的价电子排布式为 , X的元素符号是;
(2)Y元素在元素周期表中的位置是 , Y的元素名称是 , Y元素价层电子的电子排布图为;
(3)比较Y的氢化物与同族第二、第三周期元素所形成的氢化物沸点高低 , 并说明理由
(4)已知化合物Y2X3在稀硫酸溶液中可被金属锌还原为YZ3 , 产物还有ZnSO4和H2O,该反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用处理废弃的线路板得到含70%Cu、25%Al、4%Fe及少量Au、Pt的金属混合物制备硫酸铜和硫酸铝晶体,流程如图1: 
(1)步骤①~③中过滤操作所需要的玻璃仪器除烧杯、漏斗外还有 .
(2)步骤①中Cu发生的离子方程式为 , 此时该溶液中所有的金属阳离子是;步骤②中得到滤渣2的主要成分是(填化学式).
(3)滤渣3加适量稀硫酸溶解,将得到溶液进行:蒸发浓缩, , 过滤、洗涤,即得到硫酸铜晶体;由滤液3制备Al2(SO4)318H2O时,按化学反应顺序用到的试剂依次为 . (填序号)
①NaOH溶液 ②稀硫酸 ③氨水 ④二氧化碳
(4)在步骤(3)中,发生反应的第一个离子方程式是
(5)为测定制得硫酸铜晶体(CuSO4xH2O)中结晶水含量,取12.5g硫酸铜晶体进行加热分解,得到固体质量与温度的关系如图2.
已知加热过程中,硫酸铜晶体分步失去结晶水.根据图中数据,计算CuSO4xH2O中x的值为;258℃到650℃时反应的化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com