
【题目】下列措施或事实能用勒沙特列原理解释的是( )
A.在合成氨(正反应是放热)的反应中,升温有利于氨的合成
B.H2、I2、HI三者的平衡混合气,加压(缩小容器体积)后颜色变深
C.钢铁在潮湿的空气中更容易生锈
D.氯气可以用排饱和食盐水的方法收集
 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中一定能大量共存的是( )
A. 含有大量 Ba2+的溶液中:Cl- K+ ![]()
![]()
B. 含有大量H+的溶液中:Mg2+ Na+ ![]()
![]()
C. 含有大量OH-的溶液中:Mg2+ ![]()
![]()
![]()
D. 含有大量Na+的溶液中:H+ K+ ![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液分别滴加到两种一元弱酸HA和HB中,两种混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. 电离常数:Ka(HB)>Ka(HA)
B. Ka(HA)的数量级为10-5
C. 当HA与NaOH溶液混合至中性时:c(A-)=c(HA)
D. 等浓度等体积的HA和NaB混合后所得溶液中:c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)固体易溶于水,微溶于乙醇,不溶于乙醚,是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起。工业级NaN3 的制备分两步进行,反应方程式如下:
ⅰ.2Na+2NH3![]() 2NaNH2+H2
2NaNH2+H2
ⅱ.NaNH2+N2O![]() NaN3+H2O
NaN3+H2O
实验室利用如下装 置模拟工业级NaN3的制备。

回答下列问题:
实验Ⅰ:制备
(1)装置C中盛放的药品为____________________,装置D中进行油浴而不用水浴的主要原因是_______________________。
(2)N2O可由NH4NO3在240~245℃ 分解制得(硝酸铵的熔点为169.6℃),则可选择的气体发生装置是__________________(图中加热装置已略去),该反应的化学方程式为______________,在制备NaN3的实验过程中,当观察到_______________时开始通入N2O。

实验Ⅱ:分离提纯
反应完全结束后,取出装置D中的混合物进行以下操作,得到NaN3固体。

已知:NaNH2能与水反应生成NaOH 和氨气
(3)操作Ⅳ采用乙醚洗涤的原因是________________________。
实验Ⅲ:定量测定
实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:①将2.500 g试样配成500.00 mL溶液。②取50.00 mL溶液置于锥形瓶中,加入50.00 mL 0.1010 mol·L-1(NH4)2Ce(NO3)6 溶液。③充分反应后,将溶液稍稀释,向溶液中加入8 mL浓硫酸,滴入3滴邻菲哕啉指示液,用0.0500 mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑
Ce4++Fe2+=Ce3++Fe3+。
(4)配制叠氮化钠溶液时,除需用到烧杯、玻璃棒、量筒外,还用到的玻璃仪器有_____________。
(5)试样中NaN3的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。


(1)仪器A的名称是_________,水通入A的进口为_________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为______________________________________________________。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的_________;若滴定终点时溶液的pH=8.8,则选择的指示剂为_________;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)_________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为_________g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在污水治理越来越引起人们的重视,通过膜电池可以除去废水中的乙酸钠和对氯苯酚(![]() ),其原理如图所示,下列说法正确的是
),其原理如图所示,下列说法正确的是
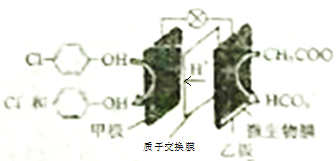
A. 甲极为电池的正极,发生氧化反应 B. 电流从乙极经导线、小灯泡流向甲极
C. 甲极的电极反应式为: ![]() D. 当外电路中有0.2mole-转移时,甲板区增加H+0.2mol
D. 当外电路中有0.2mole-转移时,甲板区增加H+0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列三个反应的化学方程式,判断有关物质的还原性的强弱顺序为( )
①I2+ SO2+ 2H2O =H2SO4+ 2HI ②2FeCl2+ Cl2= 2FeCl3
③2FeCl3+ 2HI =2FeCl2+ I2+ 2HCl
A. I-> Fe2+>Cl->SO2 B. Cl-> Fe2+> SO2>I-
C. Fe2+>I->Cl->SO2 D. SO2>I-> Fe2+>Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于常温下pH=1的硝酸溶液,有关叙述:
①该溶液1mL稀释至100mL后,pH=3
②向该溶液中加入等体积、pH=13的氢氧化钡溶液恰好完全中和
③该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为1×10﹣12
④向该溶液中加入等体积、等浓度的氨水,所得溶液pH=7
其中正确的是
A. ①② B. ①③ C. ②④ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com