
【题目】在2L密闭容器中,800℃时反应2NO(g)+O2(g)2NO2(g)△H<0,体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)能说明该反应已经达到平衡状态的是
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内物质的密度保持不变
(2)图中表示NO2的变化的曲线是 , 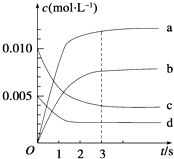
(3)用O2的浓度变化表示从0~2s内该反应的平均速率v= .
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是
a.将容器体积变为1Lb.适当升高温度c.增大O2的浓度d.选择高效的催化剂.
【答案】
(1)bc
(2)b
(3)0.0015mol?L﹣1?s﹣1
(4)ac
【解析】解:(1)a、当v (NO2)=2v (O2)时,该反应不一定达到平衡状态,故a错误; b、该反应是一个反应气体气体体积改变的可逆反应,当达到平衡状态时,各物质的浓度不变,则容器内压强保持不变,故b正确; c、v逆(NO):v正(O2)=2:1时,该反应达到平衡状态,所以当v逆(NO)=2v正(O2),该反应达到平衡状态,故c正确; d、根据质量守恒定律知,混合物质量始终不变,容器的体积不变,则容器内混合气体的密度始终不变,所以不能据此判断是否达到平衡状态,故d错误;所以答案是:bc;(2)根据表格知,随着反应的进行,一氧化氮的物质的量减小,则平衡向正反应方向移动,二氧化氮的物质的量逐渐增大,当反应达到平衡状态时,参加反应的n(NO)=(0.020﹣0.007)mol=0.013mol,根据二氧化氮和一氧化氮的关系式知,平衡状态时生成n(NO2)等于参加反应的n(NO),所以为0.013mol,c(NO2)= ![]() ,故选b,所以答案是:b;(3)0~2s时,v(NO)=
,故选b,所以答案是:b;(3)0~2s时,v(NO)= ![]() =0.003mol/(L.s),同一化学反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以v(O2)=
=0.003mol/(L.s),同一化学反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以v(O2)= ![]() v(NO)=0.0015molL﹣1s﹣1 , 所以答案是:0.0015molL﹣1s﹣1;(4)a.将容器体积变为1L,体积缩小相当于增大容器中的压强,压强增大,反应速率增大,平衡正向进行,故a正确;b.适当升高温度,反应速率增大但平衡向逆反应方向移动,故b错误; c.增大O2的浓度反应速率增大,且该反应向正反应方向移动,故c正确; d.选择高效催化剂能增大反应速率,但平衡不移动,故d错误;所以答案是:a c.
v(NO)=0.0015molL﹣1s﹣1 , 所以答案是:0.0015molL﹣1s﹣1;(4)a.将容器体积变为1L,体积缩小相当于增大容器中的压强,压强增大,反应速率增大,平衡正向进行,故a正确;b.适当升高温度,反应速率增大但平衡向逆反应方向移动,故b错误; c.增大O2的浓度反应速率增大,且该反应向正反应方向移动,故c正确; d.选择高效催化剂能增大反应速率,但平衡不移动,故d错误;所以答案是:a c.
【考点精析】通过灵活运用化学平衡状态本质及特征和化学平衡状态的判断,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等即可以解答此题.


科目:高中化学 来源: 题型:
【题目】将装有60mLNO2、NO混合气的量筒倒立于水槽中,反应后气体体积缩小为40mL,则混合气体中NO2和NO的体积比是( )
A.5:3
B.2:3
C.1:1
D.2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解,水解生成Sn02·H20)
的反应为Sn+2Cl2 ![]() SnCl4, Sn也可以与HC1反应生成SnCl2。已知:
SnCl4, Sn也可以与HC1反应生成SnCl2。已知:
物质 | 摩尔质量(g/mol) | 熔点(℃) | 沸点(℃) |
Sn | 119 | 231 | 2260 |
SnCl2 | 190 | 246 | 623 |
SnCl4 | 261 | -30 | 114 |
制备装置如图所示:
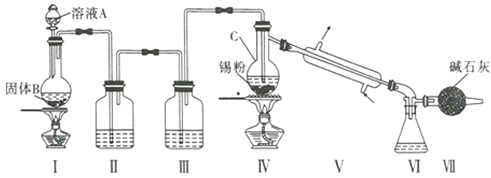
回答下列问题:
(1)Sn在元素周期表中的位罝为____________________________。
(2)II、III中的试剂分別为_______、__________;VII的作用是____________________、_____________。
(3)实验所得SnCl4因溶解了Cl2而略显黄色,提纯SnCl4的方法是____________(填序号)。
a.用NaOH溶液洗涤再蒸馏 b.升华 c.重结晶 d.蒸馏 e.过滤
(4)写出I中反应的化学方程式:_____________________________________。
(5)加热Sn粒之前要先让氯气充满整套装置,其目的是__________________________________。
(6)写出SnCl4水解的化学方程式:________________________________________。
(7)若IV中用去锡粉5.95g,反应后,VI中锥形瓶里收集到12.0gSnCl4,则SnCl4的产率为_____%。(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示的反应关系中,部分产物被略去.已知2mol白色固体粉末X受热分解,恢复到室温生成白色固体A、无色液体B、无色气体C各1mol.A、X、E、G、H的焰色反应均为黄色,且H为淡黄色固体.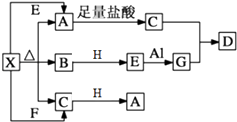
回答下列问题:
(1)写出下列物质的化学式:X , H .
(2)写出E+Al→G反应的化学方程式 , 该反应中氧化剂是 .
(3)写出G溶液中通入过量C制取D的反应离子方程式: .
(4)写出X溶液中滴加过量澄清石灰水反应的离子方程式: .
(5)0.1mol H与足量的C反应,转移的电子数为个.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种重要的化工原料,请回答下列问题:
I.高铁酸钾(K2FeO4)溶液呈紫红色,向其中加入过量亚硝酸钠后,溶液紫红色逐渐褪去,并出现红褐色沉淀,请写出该反应的离子方程式__________________。
I1.实验室模拟下图所示流程制备亚硝酸钠:

已知: ①氧化过程中,控制反应液温度在35~60℃条件下主要发生反应:
C6H12O6+ 12HNO3=3HOOC-COOH+9NO2↑+3NO↑+9H2O
②氢氧化钠溶液吸收NO 和NO2发生反应:
NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO3+NaNO2+H2O

(1)木屑的主要成分是纤维素,结合已知信息①,你认为向木屑中加稀硫酸的作用是_____ ,氧化过程中反应温度不宜高于60℃,原因是______________。
(2)不做任何处理,按此过程进行,氢氧化钠溶液吸收后的溶液中除了OH-外还有两种阴离子,其中一种是NO2-,NO2-与另一种阴离子的物质的量之比为________。
(3)装置B用于制备NaNO2,盛裝的试剂除NaOH(aq)外,还可以是_____ (填字母)。
A.NaCl(aq) B.Na2CO3(aq) C.NaNO3( aq )
Ⅲ.测定产品纯度:
[实验步骤] ①准确称量ag 产品配成200mL溶液
②从步骤①配制的溶液中移取20.00mL 加入锥形瓶中
③用c mol/L酸性KMnO4溶液滴定至终点
④重复以上操作3 次,消耗酸性KMnO4溶液的平均体积为VmL
(1)锥形瓶中发生反应的离子方程式为____________。
(2)产品中NaNO2 的纯度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关电解质溶液的叙述正确的是
A. pH=2的盐酸与pH=12的氨水等体积混合后所得溶液显中性
B. 等浓度等体积的强酸与强碱溶液混合后,溶液的pH=7
C. pH=10的Ba(OH)2溶液和pH=13的NaOH溶液等体积混合后溶液的pH=10.7(已知lg2=0.3)
D. 将l0 mL pH=a的盐酸与l00 mL pH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其中一种生产工艺如下图所示,回答下列问题:
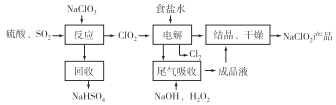
(1)NaClO2中Cl元素的化合价为_______。
(2)ClO2的沸点为11℃,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下更安全。写出“反应”步骤中生成ClO2的化学方程式:___________________。
(3)“电解”过程中阴极的主要电极反应式为__________________。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。
①此吸收反应中,还原剂与氧化剂的物质的量之比为________。(填字母代号)。
②提高尾气的吸收效率的可行措施有_______________。
A.“尾气吸收”时充分搅拌吸收液 B.适当加快尾气的通入速率
C.将温度控制在20C以下 D.加水稀释尾气吸收液
③在“尾气吸收”过程中,可代替H2O2的最佳试剂是______(填字母代号)。
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(5)ClO2和H+结合为HClO2,HClO2是唯一的亚卤酸,不稳定,易分解产生Cl2、ClO2和H2O,写出HClO2分解的化学方程式:___________________。
(6)已知NaClO2的溶解度随温度升高而增大,NaClO2饱和溶液在38℃以上60℃以下会析出NaClO2,在NaClO2析出过程中可能混有的杂质是________(任写一种,填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com