
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其中一种生产工艺如下图所示,回答下列问题:
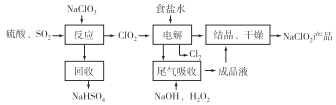
(1)NaClO2中Cl元素的化合价为_______。
(2)ClO2的沸点为11℃,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下更安全。写出“反应”步骤中生成ClO2的化学方程式:___________________。
(3)“电解”过程中阴极的主要电极反应式为__________________。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。
①此吸收反应中,还原剂与氧化剂的物质的量之比为________。(填字母代号)。
②提高尾气的吸收效率的可行措施有_______________。
A.“尾气吸收”时充分搅拌吸收液 B.适当加快尾气的通入速率
C.将温度控制在20C以下 D.加水稀释尾气吸收液
③在“尾气吸收”过程中,可代替H2O2的最佳试剂是______(填字母代号)。
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(5)ClO2和H+结合为HClO2,HClO2是唯一的亚卤酸,不稳定,易分解产生Cl2、ClO2和H2O,写出HClO2分解的化学方程式:___________________。
(6)已知NaClO2的溶解度随温度升高而增大,NaClO2饱和溶液在38℃以上60℃以下会析出NaClO2,在NaClO2析出过程中可能混有的杂质是________(任写一种,填化学式)。
【答案】 +3 2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4 ClO2+e-=ClO2- 1:2 AC A 8HClO2=Cl2↑+6ClO2↑+4H2O NaCl(或Na2SO4 或NaOH)
【解析】本题主要考查对于NaClO2一种生产工艺的评价。
(1)NaClO2中Cl元素的化合价为+3。
(2)“反应”步骤中生成ClO2的化学方程式:2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4。
(3)“电解”过程中阴极的主要电极反应式为ClO2+e-=ClO2-。
(4)①2ClO2+H2O2+2NaOH=2NaClO2+3H2O+O2,此吸收反应中,还原剂与氧化剂的物质的量之比为1:2。
②A.反应物充分接触而反应,可以提高尾气的吸收效率;B.反应不充分,不能提高尾气的吸收效率;C.减少双氧水分解,可以提高尾气的吸收效率;D.反应速率减小,不能提高尾气的吸收效率。故选AC。
③A.具有强氧化性且不引人杂质;B.C.还原性强,氧化性弱,不能代替H2O2;D.具有强氧化性,但会引人杂质。故选A。
(5)HClO2分解的化学方程式:8HClO2=Cl2↑+6ClO2↑+4H2O。
(6)在NaClO2析出过程中,溶液含有NaCl、Na2SO4、NaOH等杂质,所以可能混有的杂质是NaCl(或Na2SO4或NaOH)。


科目:高中化学 来源: 题型:
【题目】在2L密闭容器中,800℃时反应2NO(g)+O2(g)2NO2(g)△H<0,体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)能说明该反应已经达到平衡状态的是
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内物质的密度保持不变
(2)图中表示NO2的变化的曲线是 , 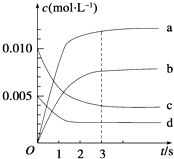
(3)用O2的浓度变化表示从0~2s内该反应的平均速率v= .
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是
a.将容器体积变为1Lb.适当升高温度c.增大O2的浓度d.选择高效的催化剂.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界著名的科技史学家、英国剑桥大学的李约瑟博士考证说:“中国至少在距今3000年以前,就已经使用玻璃了”。下列关于玻璃的叙述中,正确的是( )
A.玻璃是人类最早使用的硅酸盐材料
B.玻璃在加热熔化时有固定的熔点
C.制普通玻璃的原料主要是纯碱、石灰石和粘土
D.普通玻璃的成分主要是硅酸钠、硅酸钙和二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() 的说法正确的是
的说法正确的是
A. 所有原子可能都在同一平面上 B. 最多只可能有9个碳原子在同一平面
C. 有7个碳原子可能在同一直线 D. 只可能有5个碳原子在同一直线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)为测定一种气态烃A的化学式,取标准状况下一定体积的A置于密闭容器中,再通入一定体积的O2,用电火花引燃,定性实验表明产物是CO2、CO和水蒸气。相关方案如下:(箭头表示气体流向,实验前系统内空气已排除)
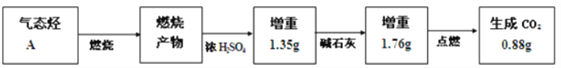
试回答(不要求写计算过程):A的实验式(最简式)是____________,根据所学知识,气态烃A的分子式为___________。
(2)质子核磁共振(PMR)是研究有机物结构的有力手段之一,在所研究的化合物分子中,每一个结构中的等性氢原子的PMR谱中都给出了相应的峰(信号),谱中峰的强度与结构中的等性氢原子数成正比。现有某有机物,化学式为C6H12。已知该物质可能存在多种结构,a、b、c是其中的三种,请根据下列要求填空:
①a与氢气加成生成2―甲基戊烷,则a的可能结构有___________种。
②b能使溴水和酸性高锰酸钾褪色,PMR谱中只有一个信号,则b的结构简式为:__________________,其命名为:______________。
③c不能使酸性高锰酸钾溶液褪色,不能与溴水加成褪色,可萃取溴水中的溴;PMR谱中也只有一个信号,则c的结构简式为:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用锌粒与稀盐酸反应制取氢气时,下列措施不能使氢气生成速率增大的是( )
A. 升高反应体系的温度 B. 增加锌粒的用量
C. 不用锌粒,改用锌粉 D. 滴入少量硫酸铜溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度(t℃)时,水的离子积为KW=1.0×10﹣13mol2L﹣2,则该温度(填“大于”、“小于”或“等于”)_____25℃,其理由是________________________________。
(2)若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计). 若所得混合液为中性,则a:b=_____;此溶液中各种离子的浓度由大到小排列顺序是_________________。
(3)FeCl3的水溶液呈酸性的原因是(用离子方程式表示):______________。
(4)实验室在配制FeCl3的溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以__ (填“促进”、“抑制”)其水解。
(5)把氯化铝溶液蒸干并灼烧固体产物是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com