
【题目】用锌粒与稀盐酸反应制取氢气时,下列措施不能使氢气生成速率增大的是( )
A. 升高反应体系的温度 B. 增加锌粒的用量
C. 不用锌粒,改用锌粉 D. 滴入少量硫酸铜溶液
科目:高中化学 来源: 题型:
【题目】常温下,下列有关电解质溶液的叙述正确的是
A. pH=2的盐酸与pH=12的氨水等体积混合后所得溶液显中性
B. 等浓度等体积的强酸与强碱溶液混合后,溶液的pH=7
C. pH=10的Ba(OH)2溶液和pH=13的NaOH溶液等体积混合后溶液的pH=10.7(已知lg2=0.3)
D. 将l0 mL pH=a的盐酸与l00 mL pH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其中一种生产工艺如下图所示,回答下列问题:
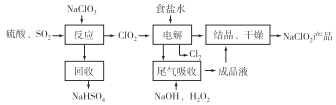
(1)NaClO2中Cl元素的化合价为_______。
(2)ClO2的沸点为11℃,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下更安全。写出“反应”步骤中生成ClO2的化学方程式:___________________。
(3)“电解”过程中阴极的主要电极反应式为__________________。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。
①此吸收反应中,还原剂与氧化剂的物质的量之比为________。(填字母代号)。
②提高尾气的吸收效率的可行措施有_______________。
A.“尾气吸收”时充分搅拌吸收液 B.适当加快尾气的通入速率
C.将温度控制在20C以下 D.加水稀释尾气吸收液
③在“尾气吸收”过程中,可代替H2O2的最佳试剂是______(填字母代号)。
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(5)ClO2和H+结合为HClO2,HClO2是唯一的亚卤酸,不稳定,易分解产生Cl2、ClO2和H2O,写出HClO2分解的化学方程式:___________________。
(6)已知NaClO2的溶解度随温度升高而增大,NaClO2饱和溶液在38℃以上60℃以下会析出NaClO2,在NaClO2析出过程中可能混有的杂质是________(任写一种,填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,密闭容器中充入一定量的NO2和SO2 , 发生如下反应:NO2+SO2 ![]() NO+SO3 , 平衡时,下列叙述正确的是( ) ①NO和SO3 的物质的量一定相等
NO+SO3 , 平衡时,下列叙述正确的是( ) ①NO和SO3 的物质的量一定相等
②NO2和SO2的物质的量一定相等
③体系中的总物质的量一定等于反应开始时总物质的量
④SO2、NO2、NO、SO3 的物质的量一定相等.
A.①和②
B.②和③
C.①和③
D.③和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验室常见物质的俗名与化学式相对应的是( )
A. 苏打-NaHCO3 B. 胆矾-CuSO4
C. 烧碱-NaOH D. 生石灰-Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取25.00 mL上述溶液,加入过量的盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g 。
方案Ⅱ:取25.00 mL上述溶液,加入过量的硝酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g 。
(1)准确配制250 mL Na2SO3溶液时,必须用到的实验仪器有:天平、烧杯、玻棒、胶头滴管、药匙和____________。
(2)写出Na2SO3固体氧化变质的化学方程式_____________________________________。
(3)方案I加入过量的盐酸酸化的BaCl2溶液,如何检验是否沉淀完全,其操作是_____________。
(4)方案I中,若滤液浑浊,将导致测定结果________(选填“偏高”或“偏低”)。
(5)由方案I :Na2SO3固体的纯度可表示为:___________。
(6)方案I、方案Ⅱ :m1________m2(填“>”、“<”或“=”)。
(7)取25.00 mL上述溶液,用滴定的方法测定Na2SO3的纯度。下列试剂可作为标准溶液进行滴定的是________。滴定终点的现象为________________________________。
A.酸性KMnO4溶液 B.H2O2溶液 C.Br2水 D.FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1mol/L NaOH溶液分别滴定100mL 0.1mol/L HA、HB两种酸溶液。pH随NaOH 溶液体积如下图所示,下列判断错误的是
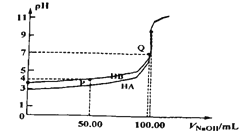
A. 电离常数: Ka(HA)> Kb(HB)
B. 由P点计算Ka(HB) ≈10-4
C. pH=7 时,c(A-)=c(B-)
D. 中和分数达100%时,HA溶液中存在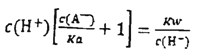
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com