
【题目】锡酸钠用作媒染剂,纺织品的防火剂、增重剂,以及制造陶瓷、玻璃和用于镀锡等。以锡锑渣(主要含Sn、Sb、As、Pb的氧化物)为原料,制备锡酸钠(Na2SnO3)的工艺流程图如下:
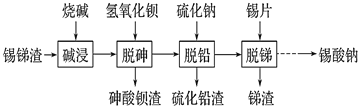
请回答下列问题:
(1) Sb(ⅤA)最高正化合价为_____。
(2) 流程中“脱砷、脱铅、脱锑”均要涉及的分离实验操作是_________。
(3)“碱浸”时,若SnO含量较高,工业上则加入NaNO3除去SnO,且检测到有NH3生成。
①该反应的离子方程式为____________________;
②如图是“碱浸”实验的参数,请选择“碱浸”的合适条件__________。

(4) “脱铅”是从含Na2PbO2的溶液中形成硫化铅渣,其离子方程式为________。
(5) “脱锑”时发生的主要化学反应属于_________。
A.置换反应 B.氧化还原反应 C.非氧化还原反应
(6) 硫酸盐光亮镀锡液成分简单,主要有硫酸亚锡、硫酸等成分。镀锡液中硫酸的作用是__________;镀锡时阳极反应式为______________。
【答案】+5 过滤 4SnO+NO3-+7OH-=NH3↑+4SnO32- +2H2O c(OH-)=2.5mol/L、温度85 ℃ PbO22-+S2-+2H2O=PbS↓+4OH- A B 抑制Sn2+的水解,促进阳极Sn的溶解 Sn-2e-=Sn2+
【解析】
(1) 一般来说,元素的最高正价等于其最外层电子数;
(2) 流程中“脱砷、脱铅、脱锑”均要进行固液分离;
(3)①该反应中,SnO与NO3-在碱性溶液中反应,生成+4价Sn的含氧酸根离子和NH3等;
②“碱浸”的合适条件是浸出率高的点对应的数值;
(4) “脱铅”是从含Na2PbO2的溶液中形成硫化铅,实质是PbO22-与S2-反应,生成PbS等;
(5) “脱锑”时锡片生成锑渣,属于置换反应;
(6) 硫酸盐光亮镀锡液成分简单,主要有硫酸亚锡、硫酸等成分。镀锡液的主要成分为硫酸亚锡,锡离子易发生水解,所以加入硫酸抑制其水解;镀锡时阳极为锡失电子,生成锡离子。
(1) Sb(ⅤA)最高正化合价=最外层电子数,即显+5价;
(2) 流程中“脱砷、脱铅、脱锑”均要进行固液分离,则分离实验操作是过滤;
(3)①该反应中,SnO与NO3-在碱性溶液中反应,生成+4价Sn的含氧酸根离子和NH3等,反应的离子方程式为4SnO+NO3-+7OH-=NH3↑+4SnO32- +2H2O;
②“碱浸”的合适条件是浸出率高的点对应的数值,即c(OH-)=2.5mol/L、温度85 ℃;
(4) “脱铅”是从含Na2PbO2的溶液中形成硫化铅,实质是PbO22-与S2-反应,生成PbS等,反应的离子方程式为PbO22-+S2-+2H2O=PbS↓+4OH-;
(5) “脱锑”时锡片生成锑渣,属于置换反应和氧化还原反应,答案为:A B;
(6) 硫酸盐光亮镀锡液成分简单,主要有硫酸亚锡、硫酸等成分,镀锡液的主要成分为硫酸亚锡,锡离子易发生水解,所以加入硫酸的作用是抑制Sn2+的水解,促进阳极Sn的溶解;镀锡时阳极反应式为Sn-2e-=Sn2+。


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.中和热测定实验中需要的玻璃仪器有:烧杯、量筒、温度计、环形玻璃搅拌棒
B.乙烯的燃烧热是1411.3kJ·mol-1,则乙烯燃烧的热化学方程式为:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g)ΔH=-1411.3kJ·mol-1
C.P(s,红磷)=P(s,黑磷),ΔH=-39.3kJ·mol-1;P(s,白磷)=P(s,红磷),ΔH=-17.6kJ·mol-1由此推知,最稳定的磷单质是黑磷
D.MgCO3分解的能量关系如图所示: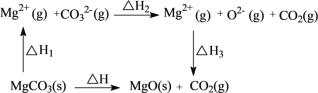 则ΔH=ΔH1+ΔH2+ΔH3
则ΔH=ΔH1+ΔH2+ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.全降解塑料( )可由环氧丙烷(
)可由环氧丙烷(![]() )和
)和![]() 在一定条件下制得
在一定条件下制得
B.在淀粉水解液中先加入过量的氢氧化钠溶液、再滴入碘水,溶液未变蓝,说明淀粉已完全水解
C.除去乙酸乙酯中的少量水分,可以用无水硫酸钠但不能用碱石灰
D.福尔马林能用于制作标本主要是使蛋白质变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.同温度下,CH3COONH4溶液显中性,所以CH3COONH4不水解。
B.在室温下稀释两种酸时pH变化如图,其中HX为弱酸,且a点与b点的![]() 数值相同
数值相同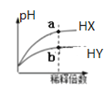
C.25℃时,等体积pH=3的HA和HB两种酸分别与足量的锌充分反应后,HA与Zn反应生成的氢气更多,HA是弱酸
D.若常温下,pH=3的HA溶液中水电离出的c(H+)为10-11mol·L-1,则能证明HA为弱酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A.CO的平衡转化率为20%B.升高温度,H2S浓度增加,表明该反应是吸热反应
C.反应前H2S物质的量为8molD.通入CO后,正反应速率逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有对氯苯酚和醋酸钠的废水净化原理如图所示。下列说法错误的是( )
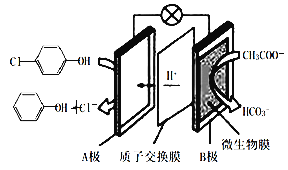
A.本装置集净化、供电于一体,产物之一还有消毒作用
B.每消耗1mol CH3COO-,通过质子交换膜的质子的物质的量为8mol
C.在该装置中,B极上的电势比A极上的电势高
D.A极的电极反应为![]() +H++2e-→
+H++2e-→![]() +Cl-
+Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是构成物质世界最重要的元素之一,能形成众多的化合物。
(1)已知0.096kg碳完全燃烧可放出3148kJ热量,1mol液态水汽化时要吸收44kJ热量。
①2H2(g)+O2(g)=2H2O(l) H=-571.6kJmol-1
②2CO(g)+O2(g)=2CO2(g) H=-566kJmol-1
请写出制备水煤气的热化学方程式_______________________。
(2)为研究CO2与CO之间的转化。让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)![]() 2CO(g) H。测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示:
2CO(g) H。测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示:

回答下列问题:
①p1、p2、p3的大小关系是__________,图中a、b、c三点对应的平衡常数大小关系是__________(用Ka、Kb、Kc表示)。
②一定条件下,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH3,向固定容积为1 L的密闭容器中充入2 mol CO2和6 mol H2,一段时间后达到平衡状态,测得CH3OH(g)的物质的量为1mol,则此条件下该反应的化学平衡常数K=_________(用分数表示);若开始时充入2 mol CH3OH(g) 和2 mol H2O(g)达到相同平衡状态时,CH3OH的转化率为_______;若平衡后再充入4 mol的N2,则c(CO2)和原平衡比较是_________。(填“增大”、“减小”、“不变”)
CH3OH(g)+H2O(g) ΔH3,向固定容积为1 L的密闭容器中充入2 mol CO2和6 mol H2,一段时间后达到平衡状态,测得CH3OH(g)的物质的量为1mol,则此条件下该反应的化学平衡常数K=_________(用分数表示);若开始时充入2 mol CH3OH(g) 和2 mol H2O(g)达到相同平衡状态时,CH3OH的转化率为_______;若平衡后再充入4 mol的N2,则c(CO2)和原平衡比较是_________。(填“增大”、“减小”、“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为:N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( )

A. 该装置工作时,Ag电极上有气体生成
B. 甲池中负极反应为N2H4-4e-=N2+4H+
C. 甲池和乙池中的溶液的pH均减小
D. 当甲池中消耗0.1molN2H4时,乙池中理论上最多产生6.4g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1molL-1的(NH4)2SO4溶液,用离子方程式表示该溶液显酸性的原因:___,在该溶液中各种离子浓度由大到小的顺序为___。
(2)B为0.1molL-1NaHCO3溶液,实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:__(用离子方程式和必要的文字说明)。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入__,目的是___;若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com