
【题目】碳是构成物质世界最重要的元素之一,能形成众多的化合物。
(1)已知0.096kg碳完全燃烧可放出3148kJ热量,1mol液态水汽化时要吸收44kJ热量。
①2H2(g)+O2(g)=2H2O(l) H=-571.6kJmol-1
②2CO(g)+O2(g)=2CO2(g) H=-566kJmol-1
请写出制备水煤气的热化学方程式_______________________。
(2)为研究CO2与CO之间的转化。让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)![]() 2CO(g) H。测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示:
2CO(g) H。测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示:

回答下列问题:
①p1、p2、p3的大小关系是__________,图中a、b、c三点对应的平衡常数大小关系是__________(用Ka、Kb、Kc表示)。
②一定条件下,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH3,向固定容积为1 L的密闭容器中充入2 mol CO2和6 mol H2,一段时间后达到平衡状态,测得CH3OH(g)的物质的量为1mol,则此条件下该反应的化学平衡常数K=_________(用分数表示);若开始时充入2 mol CH3OH(g) 和2 mol H2O(g)达到相同平衡状态时,CH3OH的转化率为_______;若平衡后再充入4 mol的N2,则c(CO2)和原平衡比较是_________。(填“增大”、“减小”、“不变”)
CH3OH(g)+H2O(g) ΔH3,向固定容积为1 L的密闭容器中充入2 mol CO2和6 mol H2,一段时间后达到平衡状态,测得CH3OH(g)的物质的量为1mol,则此条件下该反应的化学平衡常数K=_________(用分数表示);若开始时充入2 mol CH3OH(g) 和2 mol H2O(g)达到相同平衡状态时,CH3OH的转化率为_______;若平衡后再充入4 mol的N2,则c(CO2)和原平衡比较是_________。(填“增大”、“减小”、“不变”)
【答案】C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.3 kJmol-1 p1<p2<p3 Ka=Kb<Kc ![]() 50% 不变
50% 不变
【解析】
(1)根据盖斯定律计算;
(2)①方程中左边气体计量数小于右边,根据勒夏特列原理判断;
②根据三段式计算。
(1)0.096kg碳即8mol碳完全燃烧可放出3148kJ热量,1mol液态水汽化时要吸收44kJ热量,则③C(s) +O2(g)=CO2(g) H=-393.5 kJmol-1,④H2O(g)=H2O(l) H=-44 kJmol-1,根据盖斯定律,③+④-![]() ×(①+②)可得C(s)+H2O(g)=CO(g)+H2(g),ΔH=[-393.5-44-
×(①+②)可得C(s)+H2O(g)=CO(g)+H2(g),ΔH=[-393.5-44-![]() ×(-566-571.6)]kJ/mol=+131.3 kJmol-1;
×(-566-571.6)]kJ/mol=+131.3 kJmol-1;
(2)①方程中左边气体计量数小于右边,根据勒夏特列原理,压强越大,CO的百分含量则越小,根据图像可判断温度相同时,p3时CO的百分含量最小,则p1<p2<p3;根据图像,升高温度CO的百分含量增大,升高温度平衡正向移动,则K增大,K只与温度有关,Ka=Kb<Kc;
②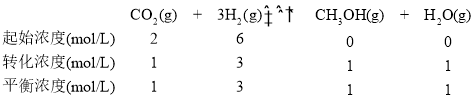
则K=![]() =
=![]() ;若开始时充入2 mol CH3OH(g)和2 mol H2O(g)达到相同平衡状态时,温度未变,则K不变,则与原平衡等效,达到平衡状态时,CH3OH的物质的量为1mol,则转化率为50%;若平衡后再充入4 mol的N2,平衡不移动,则c(CO2)和原平衡浓度相等。
;若开始时充入2 mol CH3OH(g)和2 mol H2O(g)达到相同平衡状态时,温度未变,则K不变,则与原平衡等效,达到平衡状态时,CH3OH的物质的量为1mol,则转化率为50%;若平衡后再充入4 mol的N2,平衡不移动,则c(CO2)和原平衡浓度相等。


科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是一种白色剧毒晶体,是汽车安全气囊的主要成分。NaN3易溶于水,微溶于乙醇,水溶液呈弱碱性,能与酸发生反应产生具有爆炸性的有毒气体叠氮化氢。实验室可利用亚硝酸叔丁酯(t-BuNO2,以t-Bu表示叔丁基)与N2H4、氢氧化钠溶液混合反应制备叠氮化钠。
(1)制备亚硝酸叔丁酯
取一定NaNO2溶液与50%硫酸混合,发生反应H2SO4+2NaNO2===2HNO2+Na2SO4。可利用亚硝酸与叔丁醇(t-BuOH)在40 ℃左右制备亚硝酸叔丁酯,试写出该反应的化学方程式:________________。
(2)制备叠氮化钠(NaN3)
按如图所示组装仪器(加热装置略)进行反应,反应方程式为:t-BuNO2+NaOH+N2H4===NaN3+2H2O+t-BuOH。

①装置a的名称是________________;
②该反应需控制温度在65 ℃,采用的实验措施是____________________;
③反应后溶液在0 ℃下冷却至有大量晶体析出后过滤,所得晶体使用无水乙醇洗涤。试解释低温下过滤和使用无水乙醇洗涤晶体的原因是______________________________________________。
(3)产率计算
①称取2.0 g叠氮化钠试样,配成100 mL溶液,并量取10.00 mL溶液于锥形瓶中。
②用滴定管加入0.10 mol·L-1六硝酸铈铵[(NH4)2Ce(NO3)6]溶液40.00 mL[发生的反应为2(NH4)2Ce(NO3)6+2NaN3===4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](假设杂质均不参与反应)。
③充分反应后将溶液稀释并酸化,滴入2滴邻菲罗啉指示液,并用0.10 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]为标准液,滴定过量的Ce4+,终点时消耗标准溶液20.00 mL(滴定原理:Ce4++Fe2+===Ce3++Fe3+)。计算可知叠氮化钠的质量分数为__________(保留2位有效数字)。若其他操作及读数均正确,滴定到终点后,下列操作会导致所测定样品中叠氮化钠质量分数偏大的是______(填字母代号)。
A.锥形瓶使用叠氮化钠溶液润洗
B.滴加六硝酸铈铵溶液时,滴加前仰视读数,滴加后俯视读数
C.滴加硫酸亚铁铵标准溶液时,开始时尖嘴处无气泡,结束时出现气泡
D.滴定过程中,将挂在锥形瓶壁上的硫酸亚铁铵标准液滴用蒸馏水冲进瓶内
(4)叠氮化钠有毒,可以使用次氯酸钠溶液对含有叠氮化钠的溶液进行销毁,反应后溶液碱性明显增强,且产生无色无味的无毒气体,试写出反应的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲基丙烯酸甲酯是合成有机玻璃的单体,其合成方法之一如下:CH3OC≡CH+CH3OH+A![]() CH2=C(CH3)COOCH3,下列说法正确的是( )
CH2=C(CH3)COOCH3,下列说法正确的是( )
A.已知该反应的原子利用率为100%,则A为CO2
B.CH3OH和甘油互为同系物
C.CH3C≡CH与丙烯的性质相似,则该物质可以发生加成、氧化反应
D.能与NaHCO3反应的CH2=C(CH3)COOCH3的同分异构体有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
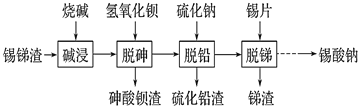
【题目】锡酸钠用作媒染剂,纺织品的防火剂、增重剂,以及制造陶瓷、玻璃和用于镀锡等。以锡锑渣(主要含Sn、Sb、As、Pb的氧化物)为原料,制备锡酸钠(Na2SnO3)的工艺流程图如下:
请回答下列问题:
(1) Sb(ⅤA)最高正化合价为_____。
(2) 流程中“脱砷、脱铅、脱锑”均要涉及的分离实验操作是_________。
(3)“碱浸”时,若SnO含量较高,工业上则加入NaNO3除去SnO,且检测到有NH3生成。
①该反应的离子方程式为____________________;
②如图是“碱浸”实验的参数,请选择“碱浸”的合适条件__________。

(4) “脱铅”是从含Na2PbO2的溶液中形成硫化铅渣,其离子方程式为________。
(5) “脱锑”时发生的主要化学反应属于_________。
A.置换反应 B.氧化还原反应 C.非氧化还原反应
(6) 硫酸盐光亮镀锡液成分简单,主要有硫酸亚锡、硫酸等成分。镀锡液中硫酸的作用是__________;镀锡时阳极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,将浓度均为0.1mol/L的HA溶液Va mL和BOH溶液Vb mL混合,保持Va+Vb=100mL,生成物BA易溶于水。Va、Vb与混合液pH的关系如下图。下列叙述错误的是

A.HA一定是弱酸
B.BOH可能是强碱
C.z点时,水的电离被促进
D.x、y、z点时,溶液中都存在c(A-)+c(OH-)=c(B+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列问题:
(1)将甘氨酸、丙氨酸,苯丙氨酸混合,在一定条件下生成的链状三肽最多有_______种;
(2)命名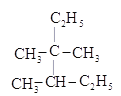 ____________________;
____________________;
(3)甲酸和新制氢氧化铜加热煮沸反应方程式_________________;
(4)分子式为![]() 的物质与浓硫酸共热,生成产物中有六元环,且只有一种化学环境的氢原子,写出该产物的结构简式____________。
的物质与浓硫酸共热,生成产物中有六元环,且只有一种化学环境的氢原子,写出该产物的结构简式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )

A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯溶液中的硫酸浓度均减少
D.甲容器中溶液即使换成酒精也可以形成原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①CO(g)+1/2O2(g)== CO2(g) ΔH=-283.0kJ/mol
②C(s)+O2(g)==CO2(g) ΔH=-393.5kJ/mol
请写出 C 与 O2 反应生成 CO 气体反应的热化学方程式: _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国第二化工设计院提出,用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图![]() 质子膜允许
质子膜允许![]() 和
和![]() 通过
通过![]() ,下列相关判断不正确的是
,下列相关判断不正确的是
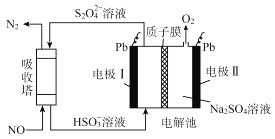
A.吸收塔中的反应为![]()
B.电极I的反应式为![]()
C.电解池中质子从电极I向电极Ⅱ作定向移动
D.每处理![]() ,电解池质量增加18g
,电解池质量增加18g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com