
【题目】保险粉学名“连二亚硫酸钠”,但实际上是不“保险”的,属于一级遇湿易燃物品,遇水后可发生剧烈反应:2Na2S2O4+2H2O+O2===4NaHSO3。在该反应中Na2S2O4表现( )
A.氧化性
B.还原性
C.既表现氧化性又表现还原性
D.既不表现氧化性也不表现还原性
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH=akJ/mol
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98kJ/mol
则a为_____________。
(2)反应2NH3(g)+CO2(g) ![]() CO(NH2)2(l)+H2O(g)在合成塔中进行。下图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比[n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
CO(NH2)2(l)+H2O(g)在合成塔中进行。下图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比[n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
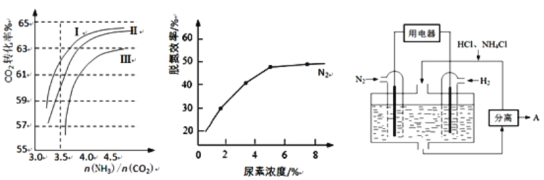
图1 图2 图3
①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值分别为:
A.0.6~0.7 B.1~1.1 C.1.5~1.61
生产中应选用水碳比的数值为_____________(选填序号)。
②生产中氨碳比宜控制在4.0左右,而不是4.5的原因可能是_____________。
(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:
NO+NO2+H2O=2HNO2
2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)=________(空气中氧气的体积含量大约为20%)。
②图2是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为________%。
(4)图3表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式_____________。生产中可分离出的物质A的化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮广泛地分布在自然界中,碳、氮的化合物性能优良,在工业生产和科技领域有重要用途。
(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700°C的氮气流中反应制得:3SiO2(s) + 6C(s) + 2N2(g)![]() Si3N4(s) + 6CO(g) △H=-1591.2 kJ·mol-1,则该反应每转移1mol e-,可放出的热量为 。
Si3N4(s) + 6CO(g) △H=-1591.2 kJ·mol-1,则该反应每转移1mol e-,可放出的热量为 。
(2)某研究小组现将三组CO(g) 与H2O(g) 的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g),得到下表数据:
CO2(g) + H2(g),得到下表数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
CO | H2O | CO | H2 | |||
1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
2 | 900 | 1 | 2 | 0.5 | 0.5 | |
① 实验1中,前5min的反应速率v(CO2) = 。
② 下列能判断实验2已经达到平衡状态的是 (填序号)。
a.容器内CO、H2O、CO2、H2的浓度不再变化
b.容器内压强不再变化
c.混合气体的密度保持不变
d.v正(CO)=v逆(CO2)
e.容器中气体的平均相对分子质量不随时间而变化
③ 若实验2的容器是绝热的密闭容器,实验测得H2O(g) 的转化率ω(H2O)随时间变化的示意图如图1所示,b点v正 v逆(填“<”、“=”或 “>”),t3~t4时刻,H2O(g) 的转化率ω(H2O)降低的原因是 。

(3)利用CO与H2可直接合成甲醇,上图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图如图2,写出以石墨为电极的电池工作时负极的电极反应式 ,利用该电池电解1L 0.5mol·L-1的CuSO4溶液,当电池消耗560mLO2(标准状况下)时,电解后溶液的pH= (溶液电解前后体积的变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉)。请回答:

(1)仪器A的名称是__________,烧瓶中反应的化学方程式是_____________________。
(2)装置B中盛放的液体是_______,气体通过装置B的目的是___________________。
装置C中盛放的液体是_______,气体通过装置C的目的是___________________。
(3)D中反应的化学方程式是_________________________________________________。
(4)烧杯E中盛放的液体是__________,反应的离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 相同类型的离子晶体,晶格能越大,形成的晶体越不稳定
B. 中心原子的杂化方式取决于其配位原子的数目
C. 用金属的电子气理论能合理的解释金属易腐蚀的原因
D. H3O+、.NH4Cl和[Ag(NH3)2]+中均存在配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质在溶液中的反应可用H++OH-===H2O表示的是( )
A.氢氧化钡和硫酸
B.氢氧化铁和盐酸
C.醋酸和氢氧化钠
D.硫酸氢钠和氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验研究发现,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出(已知硝酸的还原产物是NH4NO3)。在反虑结束后的溶液中,逐滴加入5mol/L的NaOH溶液。所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如下图所示。
则下列说法错误的是:
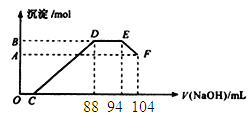
A. 铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为5:4
B. 原硝酸溶液中含硝酸的物质的量为0.5mol
C. B与A的差值为0.05 mol
D. 反应结束后的溶液仍有硝酸剩余
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com