
����Ŀ�����Ļ�����ϳɡ�Ӧ�ü����Ĺ̶�һֱ�ǿ�ѧ�о����ȵ㡣
��1����CO2��NH3Ϊԭ�Ϻϳɻ������ص���Ҫ��Ӧ���£�
��2NH3��g��+CO2��g����NH2CO2NH4��s������H��-159.47kJ/mol
��NH2CO2NH4��s����CO��NH2��2��s��+H2O��g������H��akJ/mol
��2NH3��g��+CO2��g����CO��NH2��2��s��+H2O��g������H��-86.98kJ/mol
��aΪ_____________��
��2����Ӧ2NH3��g��+CO2��g�� ![]() CO��NH2��2��l��+H2O��g���ںϳ����н��С���ͼ1��������������������Ϊ�ϳ����а���ͬ��̼��[n��NH3��/n��CO2��]��ˮ̼��[n��H2O��/n��CO2��]Ͷ��ʱ������̼ת���ʵ������
CO��NH2��2��l��+H2O��g���ںϳ����н��С���ͼ1��������������������Ϊ�ϳ����а���ͬ��̼��[n��NH3��/n��CO2��]��ˮ̼��[n��H2O��/n��CO2��]Ͷ��ʱ������̼ת���ʵ������
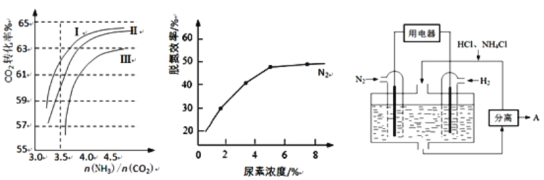
ͼ1 ͼ2 ͼ3
����������������ˮ̼�ȵ���ֵ�ֱ�Ϊ��
A.0.6��0.7 B.1��1.1 C.1.5��1.61
������Ӧѡ��ˮ̼�ȵ���ֵΪ_____________��ѡ���������
�������а�̼���˿�����4.0���ң�������4.5��ԭ�������_____________��
��3�����ؿ�����ʪ�������ѵ����գ��䷴Ӧԭ��Ϊ��
NO+NO2+H2O��2HNO2
2HNO2+CO��NH2��2��2N2��+CO2��+3H2O��
����������NO��NO2��������Ӧ��ϵ����ʱ�ѵ�Ч����ѡ���������V��NO����V��NO2����5��1ʱ����ͨ��һ�����Ŀ�����ͬ��ͬѹ�£�V����������V��NO����________�����������������������ԼΪ20%����
��ͼ2�����غ������ѵ�Ч�ʵ�Ӱ�죬�Ӿ��������Ͽ��ǣ�һ��ѡ������Ũ��ԼΪ________%��
��4��ͼ3��ʾʹ�����͵缫���ϣ���N2��H2Ϊ�缫��Ӧ���HCl-NH4ClΪ�������Һ����������ṩ������ͬʱ����ʵ�ֵ��̶�������ȼ�ϵ�ء���д���õ�ص�������Ӧʽ_____________�������пɷ����������A�Ļ�ѧʽΪ_____________��
���𰸡�
��1��+72.49��
��2����A������̼����4.5ʱ��NH3��������϶࣬��CO2��ת�������Ӳ�������������ɱ���
��3����1��1����5%��
��4��N2+6e-+8H+=2NH4+��NH4Cl��
��������
�����������1����2NH3��g��+CO2��g��=NH2CO2NH4��s������H=-159.47kJmol-1����NH2CO2NH4��s��=CO��NH2��2��s�� +H2O��g���� ��H=a kJmol-1����2NH3��g��+CO2��g��=CO��NH2��2��s��+H2O��g������H=-86.98kJmol-1�������Ȼ�ѧ����ʽ��˹������+��=�����õ�-159.47KJ/mol+a=-86.98KJ/mol��a=+72.49KJ/mol���ʴ�Ϊ��+72.49��
��2������̼����ͬʱ������������̼��ת���ʴ�����������ѡ��ˮ̼�ȵ���ֵΪA���ʴ�Ϊ��A��
����̼����4.5ʱ����Ҫ�����϶࣬������ͼ�����������̼ת�������࣬��ҵ�ϳɰ����ɹ��սϸ��ӣ���������ɱ����ʴ�Ϊ����̼����4.5ʱ��NH3��������϶࣬��CO2��ת�������Ӳ�������������ɱ���
��3������������NO��NO2��������Ӧ��ϵ����ʱ�ѵ�Ч����ѣ���1��1����������V��NO����V��NO2��=5��1ʱ����ͨ��������������Ϊx��
��2NO+O2=2NO2
2x x 2x
![]() =1��1������õ�x=1���������Ϊ5������ͬ��ͬѹ�£�V����������V��NO��=1��1���ʴ�Ϊ��1��1��
=1��1������õ�x=1���������Ϊ5������ͬ��ͬѹ�£�V����������V��NO��=1��1���ʴ�Ϊ��1��1��
��ͼ�������֪��������Ũ��Ϊ5mol/L����ʱ���ѵ�Ч�ʻ������䣬���ԴӾ��������Ͽ��ǣ�һ��ѡ������Ũ��ԼΪ5%���Ҵ�ﵽ�ϴ���ѵ�Ч�ʣ��ʴ�Ϊ��5%��
��4����N2��H2Ϊԭ�ϣ���HCl-NH4ClΪ�������Һ��������ȼ�ϵ�أ�����������ԭ��Ӧ������������ԭ����NH4+���缫��ӦʽΪN2+6e-+8H+=2NH4+������������ʧ�������������ӣ���������笠������ڵ������Һ�п��Է�����Ȼ�泥��ʴ�Ϊ��N2+6e-+8H+=2NH4+��NH4Cl��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ǽ�������A�������������Ϸ�Ӧ����B��BΪ���壬������Ƿ�Ӧ�����������������ͬ��ͬѹ�������¶�B������ɵ��Ʋ�һ����ȷ����
A����1����ԭ��
B����2����ԭ��
C����1��Aԭ��
D����2��Aԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʲ��������ֵ���ֱ�ӷ�Ӧ�õ�����
A��SO2 B��FeCl2 C��MgO D��Na2O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1Lij�����Һ�п��ܺ��е��������±���
���ܴ������е������� | H+��NH4+ ��Al3+��K+ |
���ܴ������е������� | Cl����Br����I����ClO����AlO2�� |
��1��������Һ����μ���NaOH��Һ���ʵ����ȣ�������������������ʵ�����n�������NaOH��Һ�������v���Ĺ�ϵ��ͼ��ʾ��
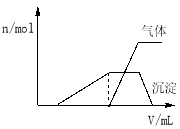
�������Һ��ȷ�����е������� ��
������ȷ���Ƿ��е��������� ��
��Ҫȷ������ڿɲ�������ʵ���� ��
���϶������ڵ��������� ��
��2������⣬����Һ�к��д�����Cl����Br����I��������1L�û����Һ��ͨ��һ������Cl2����Һ��Cl����Br����I�������ʵ�����ͨ��Cl2���������״�����Ĺ�ϵ���±���ʾ��������ش��������⣺
Cl2���������״���� | 2.8L | 5.6L | 11.2L |
n��Cl���� | 1.25mol | 1.5mol | 2mol |
n��Br���� | 1.5mol | 1.4mol | 0.9mol |
n��I���� | a mol | 0 | 0 |
����ͨ��Cl2�����Ϊ2.8Lʱ����Һ�з�����Ӧ�����ӷ���ʽΪ ��
��ԭ��Һ��Cl����Br����I�������ʵ���Ũ��֮��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ����ȷ����
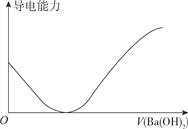
A. ��100ml0.1mol��L��1H2SO3��Һ�еμ�0.1mol��L��1Ba��OH��2��Һ������
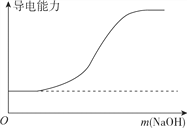
B. ��100ml0.1mol��L��1H2SO4��Һ�м���NaOH����
C. ��һ��Ũ�ȵ��Ȼ�����Һ�м�ˮ
D. ������ˮ��ͨ��HCl����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����ӵ����������ж���0.3mol/L���������Һ��˵���в���ȷ���ǣ� ��
A. 1L��Һ�к���0.6NA��������
B. 1L��Һ�к��м����Ӻ��������������Ϊ0.9NA
C. 2L��Һ�м�����Ũ��Ϊ1.2mol/L
D. 2L��Һ�к������������0.6NA��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����м�ͥСʵ�������漰��ѧ�仯����( )
A������ƻ���������㽶 B��������ʳ�׳�ȥˮ���е�ˮ��
C����Ŵ�ס�������ˮ�Ƴ������ D����ľ̿��ȥ�����е���ζ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С����0.50mol/LNaOH��Һ��0.50mol/L������Һ�����к��ȵIJⶨ��
��������0.50mol/LNaOH��Һ
��ʵ���д�ԼҪʹ��245mLNaOH��Һ��������Ҫ����NaOH����___________g
�����ⶨϡ�����ϡ���������к��ȵ�ʵ��װ������ͼ��ʾ��

ȡ50mLNaOH��Һ��30mL������Һ����ʵ�飬ʵ���������±���
��1��д���÷�Ӧ���Ȼ�ѧ����ʽΪ___________���к���Ϊ57.3kJ/mol����
��2��������д�±��еĿհף�

��������Ϊ0.50mol/LNaOH��Һ��0.50mol/L������Һ���ܶȶ���1g/cm3���кͺ�������Һ�ı�����c=4.18J/��g���������к�����H=___________��ȡС�����һλ����
������ʵ����ֵ�����57.3kJ/mol��ƫ�����ƫ���ԭ�������___________������ĸ��
a��ʵ��װ�ñ��¡�����Ч����
b����ȡNaOH��Һ�����ʱ���Ӷ���
c���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
d�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����շ�ѧ���������������ơ�����ʵ�����Dz������ա��ģ�����һ����ʪ��ȼ��Ʒ����ˮ��ɷ������ҷ�Ӧ��2Na2S2O4��2H2O��O2===4NaHSO3���ڸ÷�Ӧ��Na2S2O4���֣�������
A.������
B.��ԭ��
C.�ȱ����������ֱ��ֻ�ԭ��
D.�Ȳ�����������Ҳ�����ֻ�ԭ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com