
����Ŀ��1Lij�����Һ�п��ܺ��е��������±���
���ܴ������е������� | H+��NH4+ ��Al3+��K+ |
���ܴ������е������� | Cl����Br����I����ClO����AlO2�� |
��1��������Һ����μ���NaOH��Һ���ʵ����ȣ�������������������ʵ�����n�������NaOH��Һ�������v���Ĺ�ϵ��ͼ��ʾ��
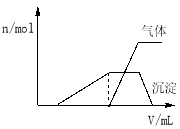
�������Һ��ȷ�����е������� ��
������ȷ���Ƿ��е��������� ��
��Ҫȷ������ڿɲ�������ʵ���� ��
���϶������ڵ��������� ��
��2������⣬����Һ�к��д�����Cl����Br����I��������1L�û����Һ��ͨ��һ������Cl2����Һ��Cl����Br����I�������ʵ�����ͨ��Cl2���������״�����Ĺ�ϵ���±���ʾ��������ش��������⣺
Cl2���������״���� | 2.8L | 5.6L | 11.2L |
n��Cl���� | 1.25mol | 1.5mol | 2mol |
n��Br���� | 1.5mol | 1.4mol | 0.9mol |
n��I���� | a mol | 0 | 0 |
����ͨ��Cl2�����Ϊ2.8Lʱ����Һ�з�����Ӧ�����ӷ���ʽΪ ��
��ԭ��Һ��Cl����Br����I�������ʵ���Ũ��֮��Ϊ ��
���𰸡���1����H+��NH4+��Al3+����K+������ɫ��Ӧ����ClO����AlO2��
��2����Cl2+2I���TI2+2Cl������10��15��4
��������
�����������1������ͼ��һ��ʼ�������ƶ���Һ��һ������H+����NaOH������ų������ƶ���Һ��һ������NH4+�����������ȫ��ʧ������Һ��ֻ����Al3+����������Mg2+��K+����ȷ������Ҫȷ��K+����ͨ����ɫ��Ӧȷ������Ϊ��Һ�к���H+������һ��������CO3 2-��AlO2-��������Һ��ȷ�����е��������У�H+��NH4+��Al3+��K+������ȷ��������Ϊ��K+���϶������ڵ��������У�CO3 2-��AlO2-��
��2����n��Cl2����2.8L��22.4L/mol��0.125mol��ͨ������������I-��Ӧ�����ɵ��ʵ⣬����ʽΪ��Cl2+2I-��I2+2Cl-��
��2.8Lʱ��n��Br-��=1.5mol����ԭ��Һ��n��Br-����1.5mol��������������n��Cl-����0.125��2��0.25mol����ԭ��Һ��n��Cl-����1.25��0.25��1mol��5.6Lʱ��n��Br-����1.5��1.4��0.1mol��n��I-����0.25��0.1��0.15����ԭ��Һ��n��I-����0.25+0.15��0.4mol����ԭ��Һ��Cl-��Br-��I-�����ʵ���Ũ��֮��Ϊ��1��1.5��0.4=10��15��4��


 �¿α�����Ķ�ѵ��ϵ�д�
�¿α�����Ķ�ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Mg��Al��Fe���ֽ����ֱ��ͬŨ�ȡ�ͬ�����ϡ���ᷴӦʱ���ų�������������ȣ�������˵������ȷ���ǣ�������
A.���ֽ������ʵ������
B.���ֽ���������
C.���ֽ������������
D.���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ���� 2a molL��1 NaOH ��Һ�ζ� 1.0 L 2a molL��1 �������Һ���õ����Һ�� HF��F�������ʵ�������Һ pH �ı仯��ͼ��ʾ������˵����ȷ����( )

A�� pH��3 ʱ����Һ�У� c(Na��)>c(F��)
B�� c(F��)>c(HF)ʱ����Һһ���ʼ���
C�� pH��4 ʱ����Һ�У�c(HF)��c(Na��)��c(H��)��c(OH��)< 2a molL��1
D�� pH��3.45 ʱ��NaOH ��Һǡ���� HF ��ȫ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��HΪ��ѧ��ѧ�м��ֳ������ʣ�����֮���ת����ϵ����ͼ��ʾ�������£�A��G��Ϊ�������壬ͬ��C�������������EΪ��ɫ����ζ��Һ�壬FΪ����ɫ��ĩ��
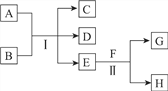
�ش��������⣺
��1��F�Ļ�ѧʽΪ________����Ӧ����ÿ����1molG��ת�Ƶ�����ĿΪ________��
��2����Ӧ���Ļ�ѧ����ʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���ó�����Fe2O3��FeO��Ҳ����Al2O3��MnO2��CuO��SiO2�ȣ��Ʊ��̷���FeSO4��7H2O�����������£�
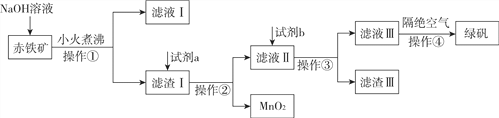
��1����Һ������������������________��
��2���Լ�aΪ________���Լ�bͶ�뵽��Һ�����������з�Ӧ�Ļ�ѧ����ʽΪ________��
��3��ʵ�����в���������IJ���������________��
��4��������������Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£��ڱ������ˮϡ�͵Ĺ����У���Һ�ĵ���������I�����ż���ˮ�����V�仯��������ͼ��ʾ������˵����ȷ������ ��
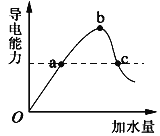
A��a��c����pH��ͬ
B����c��Һ�м�ˮ����Һ����������Ũ�ȶ���С
C������ʪ���pH��ֽ��b��pH���ƫ��
D��![]() b�����c��
b�����c��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ļ�����ϳɡ�Ӧ�ü����Ĺ̶�һֱ�ǿ�ѧ�о����ȵ㡣
��1����CO2��NH3Ϊԭ�Ϻϳɻ������ص���Ҫ��Ӧ���£�
��2NH3��g��+CO2��g����NH2CO2NH4��s������H��-159.47kJ/mol
��NH2CO2NH4��s����CO��NH2��2��s��+H2O��g������H��akJ/mol
��2NH3��g��+CO2��g����CO��NH2��2��s��+H2O��g������H��-86.98kJ/mol
��aΪ_____________��
��2����Ӧ2NH3��g��+CO2��g�� ![]() CO��NH2��2��l��+H2O��g���ںϳ����н��С���ͼ1��������������������Ϊ�ϳ����а���ͬ��̼��[n��NH3��/n��CO2��]��ˮ̼��[n��H2O��/n��CO2��]Ͷ��ʱ������̼ת���ʵ������
CO��NH2��2��l��+H2O��g���ںϳ����н��С���ͼ1��������������������Ϊ�ϳ����а���ͬ��̼��[n��NH3��/n��CO2��]��ˮ̼��[n��H2O��/n��CO2��]Ͷ��ʱ������̼ת���ʵ������
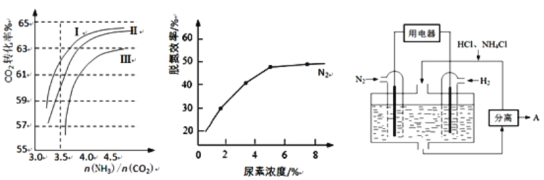
ͼ1 ͼ2 ͼ3
����������������ˮ̼�ȵ���ֵ�ֱ�Ϊ��
A.0.6��0.7 B.1��1.1 C.1.5��1.61
������Ӧѡ��ˮ̼�ȵ���ֵΪ_____________��ѡ���������
�������а�̼���˿�����4.0���ң�������4.5��ԭ�������_____________��
��3�����ؿ�����ʪ�������ѵ����գ��䷴Ӧԭ��Ϊ��
NO+NO2+H2O��2HNO2
2HNO2+CO��NH2��2��2N2��+CO2��+3H2O��
����������NO��NO2��������Ӧ��ϵ����ʱ�ѵ�Ч����ѡ���������V��NO����V��NO2����5��1ʱ����ͨ��һ�����Ŀ�����ͬ��ͬѹ�£�V����������V��NO����________�����������������������ԼΪ20%����
��ͼ2�����غ������ѵ�Ч�ʵ�Ӱ�죬�Ӿ��������Ͽ��ǣ�һ��ѡ������Ũ��ԼΪ________%��
��4��ͼ3��ʾʹ�����͵缫���ϣ���N2��H2Ϊ�缫��Ӧ���HCl-NH4ClΪ�������Һ����������ṩ������ͬʱ����ʵ�ֵ��̶�������ȼ�ϵ�ء���д���õ�ص�������Ӧʽ_____________�������пɷ����������A�Ļ�ѧʽΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A.�������Ϲ������ʹ����Ҫ��Ϊ�˽�Լ�ɱ�
B.ʹ�ÿɽ������ϴ������ڼ�������ɫ��Ⱦ��
C.������ϩ���ϴ���������ʱ����ʳƷ
D.���Ϲ���������ȹ��ԣ����ܻ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��������A�е�Ũ����μӵ�ʢ��MnO2����ƿ�У����Ⱥ��������������ͨ��װ��B��C��Ȼ����ͨ�����ȵ�ʯӢ������D�����������ۣ�����ش�

��1������A��������__________����ƿ�з�Ӧ�Ļ�ѧ����ʽ��_____________________��
��2��װ��B��ʢ����Һ����_______������ͨ��װ��B��Ŀ����___________________��
װ��C��ʢ�ŵ�Һ����_______������ͨ��װ��C��Ŀ����___________________��
��3��D�з�Ӧ�Ļ�ѧ����ʽ��_________________________________________________��
��4���ձ�E��ʢ�ŵ�Һ����__________����Ӧ�����ӷ���ʽ��__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com