
����Ŀ����ͼ��ʾ��������A�е�Ũ����μӵ�ʢ��MnO2����ƿ�У����Ⱥ��������������ͨ��װ��B��C��Ȼ����ͨ�����ȵ�ʯӢ������D�����������ۣ�����ش�

��1������A��������__________����ƿ�з�Ӧ�Ļ�ѧ����ʽ��_____________________��
��2��װ��B��ʢ����Һ����_______������ͨ��װ��B��Ŀ����___________________��
װ��C��ʢ�ŵ�Һ����_______������ͨ��װ��C��Ŀ����___________________��
��3��D�з�Ӧ�Ļ�ѧ����ʽ��_________________________________________________��
��4���ձ�E��ʢ�ŵ�Һ����__________����Ӧ�����ӷ���ʽ��__________��
���𰸡� ��Һ©�� 4HCl(Ũ)��MnO2![]() MnCl2��Cl2����2H2O ����NaCl��Һ ���������л��е�����HCl Ũ���� ����ˮ�������������� 2Fe��3Cl2
MnCl2��Cl2����2H2O ����NaCl��Һ ���������л��е�����HCl Ũ���� ����ˮ�������������� 2Fe��3Cl2![]() 2FeCl3 NaOH��Һ 2OH����Cl2��Cl����ClO����H2O
2FeCl3 NaOH��Һ 2OH����Cl2��Cl����ClO����H2O
����������1��װ����AΪ��Һ©������������ƿ�м���Ũ����Ͷ������̻���ȷ�Ӧ�����Ȼ��̡�������ˮ����Ӧ�Ļ�ѧ����ʽΪ��4HCl��Ũ��+MnO2![]() MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��
��2����Ӧ���ɵ������к����Ȼ����ˮ�����������壬�Ȼ��⼫������ˮ�������ڱ���ʳ��ˮ���ܽ��Լ�����ͨ������ʳ��ˮ��ȥ�Ȼ������壬ͨ��Ũ������Һ����ˮ������װ��B��ʢ��Һ���DZ���ʳ��ˮ������ͨ��װ��B��Ŀ�������������л��е�����HCl��װ��C��ʢ�ŵ�Һ����Ũ���ᣬ����ͨ��װ��C��Ŀ��������ˮ����������������
��3�����������ͨ��װ��D�������������������·�Ӧ�����Ȼ����ķ�Ӧ����Ӧ�Ļ�ѧ����ʽΪ��2Fe+3Cl2![]() 2FeCl3��
2FeCl3��
��4�������ж��������ŷŵ������У�װ��E������������Һ����������δ��Ӧ����������ֹ��Ⱦ����������������������Һ��Ӧ�����Ȼ��ơ��������ƺ�ˮ����Ӧ�����ӷ���ʽΪ��2OH-+Cl2=Cl-+ClO-+H2O��


 С�����ϵ�д�
С�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1Lij�����Һ�п��ܺ��е��������±���
���ܴ������е������� | H+��NH4+ ��Al3+��K+ |
���ܴ������е������� | Cl����Br����I����ClO����AlO2�� |
��1��������Һ����μ���NaOH��Һ���ʵ����ȣ�������������������ʵ�����n�������NaOH��Һ�������v���Ĺ�ϵ��ͼ��ʾ��
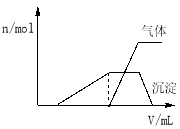
�������Һ��ȷ�����е������� ��
������ȷ���Ƿ��е��������� ��
��Ҫȷ������ڿɲ�������ʵ���� ��
���϶������ڵ��������� ��
��2������⣬����Һ�к��д�����Cl����Br����I��������1L�û����Һ��ͨ��һ������Cl2����Һ��Cl����Br����I�������ʵ�����ͨ��Cl2���������״�����Ĺ�ϵ���±���ʾ��������ش��������⣺
Cl2���������״���� | 2.8L | 5.6L | 11.2L |
n��Cl���� | 1.25mol | 1.5mol | 2mol |
n��Br���� | 1.5mol | 1.4mol | 0.9mol |
n��I���� | a mol | 0 | 0 |
����ͨ��Cl2�����Ϊ2.8Lʱ����Һ�з�����Ӧ�����ӷ���ʽΪ ��
��ԭ��Һ��Cl����Br����I�������ʵ���Ũ��֮��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С����0.50mol/LNaOH��Һ��0.50mol/L������Һ�����к��ȵIJⶨ��
��������0.50mol/LNaOH��Һ
��ʵ���д�ԼҪʹ��245mLNaOH��Һ��������Ҫ����NaOH����___________g
�����ⶨϡ�����ϡ���������к��ȵ�ʵ��װ������ͼ��ʾ��

ȡ50mLNaOH��Һ��30mL������Һ����ʵ�飬ʵ���������±���
��1��д���÷�Ӧ���Ȼ�ѧ����ʽΪ___________���к���Ϊ57.3kJ/mol����
��2��������д�±��еĿհף�

��������Ϊ0.50mol/LNaOH��Һ��0.50mol/L������Һ���ܶȶ���1g/cm3���кͺ�������Һ�ı�����c=4.18J/��g���������к�����H=___________��ȡС�����һλ����
������ʵ����ֵ�����57.3kJ/mol��ƫ�����ƫ���ԭ�������___________������ĸ��
a��ʵ��װ�ñ��¡�����Ч����
b����ȡNaOH��Һ�����ʱ���Ӷ���
c���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
d�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪AΪ�����еij���������CΪ���Ժ�ɫ���壬A��B��C��D֮��ת����ϵ

��1��д���������ʵĻ�ѧʽA_________��C__________��D___________��
��2��C+�����B+D�����ӷ���ʽΪ____________________________��D����Һ����Ϊ
ӡˢ��·�塰��ʴҺ����д���÷�Ӧ�Ļ�ѧ����ʽ______________________��
��3��ʵ���ұ���B����Һʱ����������A��ԭ����_________________________����
���ӷ���ʽ��ʾ��
��4����B��Һ�еμ�NaOH��Һ��������������___________________������������
����������ԭ��Ӧ�Ļ�ѧ����ʽ��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʷ������ȷ������� ��
�� | �� | �� | ���������� | |
A | ���� | ���� | �ռ� | ������̼ |
B | �ռ� | ���� | ʳ�� | һ����̼ |
C | ������ | ���� | ʯ��ʯ | ˮ |
D | ���Լ� | ���� | �մ� | �������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У��Ⱥ����Ӽ��ֺ����ۼ�����
A. NaCl B. CO2 C. NaOH D. Ne
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����շ�ѧ���������������ơ�����ʵ�����Dz������ա��ģ�����һ����ʪ��ȼ��Ʒ����ˮ��ɷ������ҷ�Ӧ��2Na2S2O4��2H2O��O2===4NaHSO3���ڸ÷�Ӧ��Na2S2O4���֣�������
A.������
B.��ԭ��
C.�ȱ����������ֱ��ֻ�ԭ��
D.�Ȳ�����������Ҳ�����ֻ�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I��ijѧ����0.2000 mol��L-1�ı�NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬ������ɷ�Ϊ���¼�����
��������ˮϴ�Ӽ�ʽ�ζ��ܣ���ע��NaOH��Һ����0���̶�������
���̶��õζ��ܲ�ʹ�ζ��ܼ������Һ��
������Һ������0������0���̶������£������¶���
����ȡ20.00mL����Һע����ϴ������ƿ�У�������1��2�η�̪��Һ
������һ�α�Һ����Һ��ɫ����ɫ��Ϊ��ɫ����ֹͣ�ζ�����¼Һ�����
��ش�
��1�����ϲ����д�������������� ��
��2���ñ�NaOH��Һ�ζ�ʱ��Ӧ����NaOH��Һע��_________�С�����ͼ��ѡ������������������

��3�����в���������ʵ����ƫ����ǣ�_________��������
A����ʽ�ζ���δ��ϴ
B���ζ�ǰ���ζ��ܼ��������ݣ��ζ���������
C����ƿ��������ˮϴ�Ӻ�δ�ô���Һ��ϴ
D���ζ�����ʱ���ӵζ��ܣ�����¼����
E.�ζ���������һ�α�Һ�ɽ�����ƿ
��4���ζ�ʱ�����ֿ��Ƶζ��ܣ�����ҡ����ƿ���۾�ע�� ��
II.�����к͵ζ���ԭ�����ڹ�ҵ�����л����Խ���������ԭ�ζ��ⶨ���ʺ�����
�Ʊ�����TiO2�ķ���֮һ��TiCl4ˮ������TiO2��xH2O�������ˡ�ˮϴ��ȥ���е�Cl-���ٺ�ɡ����ճ�ȥˮ�ֵõ���״TiO2��
���ִ����������ⶨTiO2���ӵĴ�С����������ԭ�ζ����ⶨTiO2������������һ�������£���TiO2�ܽⲢ��ԭΪTi3+������KSCN��Һ��ָʾ������NH4Fe��SO4��2����Һ�ζ�Ti3+��ȫ������Ti4+��
��ش��������⣺
��5����ȥTiCl4���е�����A3+��ѡ�õ���pH�ķ���ʹ��ת��ΪA��OH��3������ȥ����֪Al��OH��3��![]() �����뽫Al3+��ȫ�����������������ӵij�����������Һ��pHһ������С��__________����
�����뽫Al3+��ȫ�����������������ӵij�����������Һ��pHһ������С��__________����![]() ʱ��������Ϊ��ȫ������
ʱ��������Ϊ��ȫ������
��6��TiCl4ˮ������TiO2��xH2O�Ļ�ѧ����ʽΪ__________________________��
��7���ζ��յ��������___________________________��
��8���ζ�����ʱ����ȡTiO2��Ħ������ΪM g��mol-1������w g������c mol��L-1NH4Fe��SO4��2����ҺV mL����TiO2������������ʽΪ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܹ���������BaCl2��NaCl��Na2CO3�������ʵ��Լ��ǣ�������
A.AgNO3��Һ
B.ϡ����
C.ϡ����
D.ϡ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com