
【题目】溴苯是一种常见的化工原料。查阅资料知:苯和液溴在溴化铁(FeBr3)存在的条件下可发生反应生成溴苯,此反应为放热反应。实验室合成溴苯的装置示意图及有关数据如下。先向A中加入16.0mL的无水苯和5.0mL液溴,再将混合液慢慢滴入反应器B中。请回答下列问题:
苯 | 溴 | 溴苯 | |
相对分子质量 | 78 | 160 | 157 |
颜色状态 | 无色液体 | 深红棕色液体 | 无色液体 |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中的溶解性 | 难溶 | 微溶 | 难溶 |

(1)仪器A的名称为____。
(2)反应器B中发生的主要有机反应的化学方程式是___。
(3)下列关于该实验操作或叙述错误的是___(填字母序号)。
a.向反应器B中滴加苯和溴的混合液前需先关闭K
b.实验中装置C中的液体逐渐变为浅红色
c.实验中装置D中的导管口附近有白雾产生,溶液中产生淡黄色的沉淀,根据该现象说明苯和液溴发生的反应为加成反应
d.装置D中的导管不能插入液面以下和装置E中导管末端连接倒扣着的漏斗都是为了防倒吸
e.溴苯不能与AgNO3溶液反应产生淡黄色沉淀
(4)实验完毕待冷却后,经过下列步骤对溴苯进行分离提纯:
①向B中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。用NaOH溶液洗涤的作用是___;
③向分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤。
(5)经过上述分离操作后,粗溴苯中还含有的主要杂质为__,要进一步提纯,下列操作中必须的是___。
a.萃取 b.蒸馏 c.重结晶 d.过滤 e.分液
(6)若经过上述分离提纯的操作,经进一步精制得到6.2mL的溴苯,则该实验中溴苯的产率是___(计算结果保留三位有效数字)。
【答案】分液漏斗 ![]() +Br2
+Br2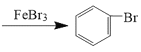 +HBr ac 除去溶解在溴苯中没有反应完的溴 苯 b 61.1%
+HBr ac 除去溶解在溴苯中没有反应完的溴 苯 b 61.1%
【解析】
(1)仪器A为分液漏斗,可以控制苯、溴混合液的滴加速率,从而控制反应速率,故答案为:分液漏斗;
(2)容器B中为苯和液溴在溴化铁(FeBr3)存在的条件下反应生成溴苯和HBr,反应方程式为![]() +Br2
+Br2 +HBr,故答案为:
+HBr,故答案为:![]() +Br2
+Br2 +HBr;
+HBr;
(3)a.向反应器B中滴加苯和溴的混合液前需先打开K,否则苯、溴的混合液不能顺利滴下,a错误;
b.Br2易挥发,挥发至装置C中溶于CCl4呈浅红色,b正确;
c.实验中装置D中的导管口附近有白雾产生,溶液中产生淡黄色的沉淀,说明苯和液溴反应有HBr生成,为取代反应,c错误;
d.HBr极易溶于水,因此装置D中的导管不能插入液面以下和装置E中导管末端连接倒扣着的漏斗都是为了防倒吸,d正确;
e.溴苯不会电离出Br-,因此溴苯不能与AgNO3溶液反应产生淡黄色沉淀,e正确;
故答案为:ac;
(4)Br2能与NaOH发生反应,因此可用NaOH溶液除去溶解在溴苯中没有反应完的溴,故答案为:除去溶解在溴苯中没有反应完的溴;
(5)由题干条件可知,苯过量,粗溴苯中还含有过量的未反应的苯,溴苯和苯的沸点差异较大,可用蒸馏的方法除去,故答案为:苯;b;
(6)由题干信息可知,苯的物质的量为![]() ,Br2的物质的量为
,Br2的物质的量为![]() ,则苯过量,以Br2的物质的量计算,理论上生成0.097mol溴苯,质量为0.0968mol×157g/mol=15.2g,实际生成溴苯的质量为6.2mL×1.50g·cm-3=9.3g,则溴苯的产率为
,则苯过量,以Br2的物质的量计算,理论上生成0.097mol溴苯,质量为0.0968mol×157g/mol=15.2g,实际生成溴苯的质量为6.2mL×1.50g·cm-3=9.3g,则溴苯的产率为![]() ,故答案为:61.1%。
,故答案为:61.1%。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法不正确的是

A. 该过程的总反应:C6H6O+7O2![]() 6CO2+3H2O
6CO2+3H2O
B. 该过程中BMO表现较强氧化性
C. 降解产物的分子中只含有极性共价键
D. ①和②中被降解的苯酚的物质的量之比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组设计如图所示实验装置探究H2S的制法和性质。若装置A产生的是有臭鸡蛋气味的硫化氢气体,则下列说法错误的是( )

A.装置B中的现象可证明溴的非金属性比硫强
B.酸X可以是稀硝酸
C.装置C中的现象可证明CuS难溶于稀硫酸
D.能观察到装置D中溶液的红色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知FeSO47H2O晶体在加热条件下会发生分解反应:2FeSO47H2O![]() Fe2O3+SO2↑+SO3↑+14H2O↑,实验室用如图所示装置检验FeSO47H2O的所有分解产物,下列说法不正确的是( )
Fe2O3+SO2↑+SO3↑+14H2O↑,实验室用如图所示装置检验FeSO47H2O的所有分解产物,下列说法不正确的是( )
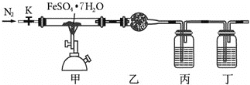
A.实验时应先打开K,缓缓通入N2,再点燃酒精喷灯
B.乙、丙、丁中可依次盛装无水CuSO4、品红溶液、BaCl2溶液
C.还应在丁装置后面连接盛有NaOH溶液的洗气瓶
D.甲中残留固体加稀硫酸溶解,再滴加KSCN溶液,溶液变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个温度恒定、容积固定的密闭容器中,发生可逆反应
mA(s)+nB(g) ![]() pC(g)+qD(g),已知n=p+q,且该反应为放热反应,反应达到平衡的标志是( )
pC(g)+qD(g),已知n=p+q,且该反应为放热反应,反应达到平衡的标志是( )
①体系的压强不再改变 ②气体的密度不再改变
③各气体的浓度不再改变 ④各气体的质量分数不再改变
⑤反应速率v(C)∶v(D)=p∶q
⑥单位时间内nmol B断键反应,同时pmol C也断键反应
A. ②③④⑥ B. ①②③④ C. ①②③④⑥ D. ④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
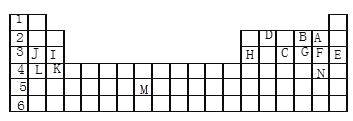
(1)表中用字母标出的14种元素中,化学性质最不活泼的是____(用元素符号表示,下同),金属性最强的是____,非金属性最强的是____,常温下单质为液态的非金属元素是____,属于过渡元素的是____(该空用字母表示)。
(2)B,F,C气态氢化物中最不稳定的是____。
(3)第三周期中原子半径最小的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
I.将水蒸气通过红热的炭即可产生水煤气。反应为:
C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
能使化学反应速率加快的措施有________(填序号)。
①增加C的物质的量 ②升高反应温度
③随时吸收CO、H2转化为CH3OH ④密闭定容容器中充入CO(g)
II.工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g).
CH3OH(g).

(1)图1是表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况.从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=________________________;
(2)图2表示该反应进行过程中能量的变化.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.写出该反应的热化学方程式___________;
(3)该反应平衡常数K为___________;
(4)恒容条件下,下列措施中能使![]() 增大的有__________;
增大的有__________;
a.升高温度 b.充入He气c.再充入2molH2 d.使用催化剂.
III. 下图是表示在一容积为2 L的密闭容器内加入2 mol的CO和6 mol的H2,在一定条件下发生如下反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0,该反应的逆反应速率与时间的关系曲线:
CH3OH(g) ΔH<0,该反应的逆反应速率与时间的关系曲线:

①由图可知反应在t1、t3、t7时都达到了平衡,而在t2、t8时都改变了条件,试判断t8时改变的条件可能是_______________。
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向HCl、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )

A. M点对应的溶液中:K+、Fe2+、SO42-、NO3-
B. N点对应的溶液中:K+、NH4+、Cl-、CO32-
C. S点对应的溶液中:Na+、SO42-、HCO3-、NO3-
D. R点对应的溶液中:Na+、SO42-、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定不同温度下0.5 mol·L-1 CuSO4溶液和0.5 mol·L-1 Na2CO3溶液pH,数据如下表:
温度/℃ | 25 | 30 | 40 | 50 | 60 |
CuSO4(aq) pH | 3.71 | 3.51 | 3.44 | 3.25 | 3.14 |
Na2CO3(aq) pH | 10.41 | 10.30 | 10.28 | 10.25 | 10.18 |
下列说法不正确的是
A. 升高温度,Na2CO3溶液中c(OH-)增大
B. 升高温度,CuSO4溶液和Na2CO3溶液的水解平衡均正向移动
C. 升高温度,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D. 升高温度,可能导致CO32-结合H+程度大于H2O电离产生H+程度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com