
科目:高中化学 来源: 题型:选择题
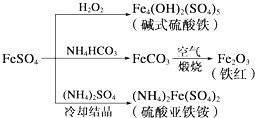
| A. | 制备碱式硫酸铁利用了过氧化氢的氧化性 | |
| B. | 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 | |
| C. | 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 | |
| D. | 制备(NH4)2Fe(SO4)2利用了它的溶解度比FeSO4的溶解度大这一性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气,NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气,NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为SiO2是H2SiO3的酸酐,故SiO2溶于水得H2SiO3 | |
| B. | CO2通入水玻璃(Na2SiO3的水溶液)中可以得到硅酸沉淀 | |
| C. | 因为高温时发生反应:Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强 | |
| D. | SiO2是酸性氧化物,它不溶于任何酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 中国科学家屠呦呦因创制了具有国际影响的新型抗疟药--青蒿素和双氢青蒿素,获得2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )
中国科学家屠呦呦因创制了具有国际影响的新型抗疟药--青蒿素和双氢青蒿素,获得2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )| A. | 分子中含有3种官能团 | |
| B. | 易溶于苯,难溶于水 | |
| C. | 可与NaOH溶液发生水解反应 | |
| D. | 其同分异构体不可能有芳香族化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol•L-1Na2SO4溶液中含有Na+和SO42-总物质的量为0.6mol | |
| B. | 50mL2mol•L-1NaCl溶液和100mL0.5mol•L-1MgCl2溶液中,Cl-的物质的量浓度相等 | |
| C. | 用1L水吸收22.4L氯化氢所得盐酸的浓度是1mol•L-1 | |
| D. | 10g98%的硫酸(密度为1.84g•cm-3)与10mL18.4mol•L-1的硫酸的浓度是相同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能与NaOH溶液反应 | |
| B. | 能使品红溶液褪色 | |
| C. | 见光能分解 | |
| D. | 向Ca(ClO)2 溶液中通入CO2能生成次氯酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com