
 目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气,NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气,NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:分析 (1)根据v=$\frac{△c}{△t}$计算v(N2),再利用速率之比等于化学计量数之比计算v(NO),再根据n=△c×V计算参加反应CO的物质的量,进而计算CO的转化率;
(2)15min到达平衡,△n(CO2)=△n(CO)=1.2mol-0.8mol=0.4mol,CO2与KOH物质的量之比为1:2,则反应生成K2CO3,溶液中碳酸根离子水解溶液呈碱性,溶液中氢氧根离子源于水的电离与碳酸根、碳酸氢根离子水解等;
(3)a.缩小容器体积,压强增大,平衡向正反应方向移动,移动结果不能消除CO浓度增大;
b.扩大容器体积,压强减小,平衡向逆反应方向移动,平衡时CO浓度减小;
c.增加NO的量,平衡正向移动;
d.降低温度,平衡向正反应方向移动;
e.增加CO的量,CO的浓度增大;
f.使用催化剂平衡不移动;
(4)温度不变,平衡常数不变,计算平衡时各组分的浓度,代入平衡常数K=$\frac{{c}^{2}(C{O}_{2})×c({N}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$,再计算此时浓度商Qc,与平衡常数相比,判断反应进行方向.
解答 解:(1)由图可知,15min N2的浓度变化量为0.2mol/L,速率之比等于化学计量数之比,则v(NO)=2v(N2)=2×$\frac{0.2mol/L}{15min}$=0.0267mol/(L•min),参加反应的CO为2L×(1.2-0.8)mol/L=0.8mol,故CO的转化率为$\frac{0.8mol}{2mol}$×100%=40.0%,
故答案为:0.0267mol/(L•min);40.0%;
(2)15min到达平衡,△n(CO2)=△n(CO)=1.2mol-0.8mol=0.4mol,CO2与KOH物质的量之比为1:2,则反应生成K2CO3,溶液中碳酸根离子水解溶液呈碱性,溶液中氢氧根离子源于水的电离与碳酸根、碳酸氢根离子水解,故溶液中c(K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),
故答案为:c(K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
(3)a.缩小容器体积,压强增大,平衡向正反应方向移动,移动结果不能消除CO浓度增大,平衡时CO浓度增大,故a正确;
b.扩大容器体积,压强减小,平衡向逆反应方向移动,平衡时CO浓度减小,故b错误;
c.增加NO的量,平衡正向移动,CO浓度减小,故c错误;
d.降低温度,平衡向正反应方向移动,CO浓度减小,故d错误;
e.增加CO的量,CO的浓度增大,故e正确;
f.使用催化剂平衡不移动,CO浓度不变,故f错误,
故选:ae;
(4)平衡时氮气浓度变化量为0.2mol/L,NO的起始浓度为$\frac{2mol}{2L}$=1mol/L、CO的起始浓度为$\frac{2.4mol}{2L}$=1.2mol/L,则:
2NO(g)+2CO(g)?2CO2(g)+N2(g)
开始(mol/L):1 1.2 0 0
转化(mol/L):0.4 0.4 0.4 0.2
平衡(mol/L):0.6 0.8 0.4 0.2
故平衡常数K=$\frac{{c}^{2}(C{O}_{2})×c({N}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$=$\frac{0.{4}^{2}×0.2}{0.{6}^{2}×0.{8}^{2}}$L/mol=$\frac{5}{36}$L/mol=0.139L/mol,
20min时再向容器中充入CO、CO2各0.4mol,此时浓度商Qc=$\frac{(0.4+\frac{0.4}{2})^{2}×0.2}{0.{6}^{2}×(0.8+\frac{0.4}{2})^{2}}$=0.2>K=0.139,故反应向逆反应进行,即向左移动,
温度不变,平衡常数不变,即重新达到平衡后,该反应的化学平衡常数为0.139L/mol,
故答案为:向左;0.139L/mol.
点评 本题考查化学平衡计算与影响因素、化学反应速率的计算、平衡常数计算与应用、离子浓度大小比较等,是对学生综合能力的考查,需要学生具备扎实的基础与灵活应用能力,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 已知实验室制备1,2-二溴乙烷可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.
已知实验室制备1,2-二溴乙烷可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
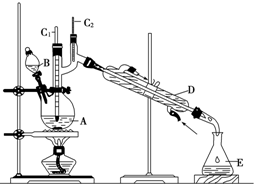 正丁醛是一种化工原料.某实验小组利用如右装置合成正丁醛.
正丁醛是一种化工原料.某实验小组利用如右装置合成正丁醛.| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高效利用CO2是“低碳经济”的有效途径,现有以下两种利用CO2的方法.
高效利用CO2是“低碳经济”的有效途径,现有以下两种利用CO2的方法.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(N2) | 0 | 0.20 | 0.35 | 0.40 | 0.40 |
| T2 | n(N2) | 0 | 0.25 | … | 0.30 | 0.30 |
| A. | T1温度下,CH4的平衡转化率为50% | |
| B. | T1<T2 | |
| C. | a<0 | |
| D. | T2时反应的平衡常数大于T1时反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com