

分析 Na2CO3溶液可以和BaCl2溶液、稀硫酸、MgSO4溶液、Cu(NO3)2溶液这四种物质反应发生反应,只有③和四种物质反应,故③为Na2CO3溶液;和碳酸钠③不反应的是⑥,故⑥为铁;BaCl2溶液可以和Na2CO3溶液、MgSO4溶液、稀硫酸三种物质之间发生反应,稀硫酸可以和铁、BaCl2溶液和Na2CO3溶液反应,图示中②④可以和三种物质反应,但④和铁⑥发生反应,故④为稀硫酸,②为BaCl2溶液;⑤和碳酸钠③及铁⑥,⑤为Cu(NO3)2溶液;①和②BaCl2溶液反应,故①为MgSO4溶液;据此根据物质间的反应来判断回答.
解答 解:Na2CO3溶液可以和BaCl2溶液、稀硫酸、MgSO4溶液、Cu(NO3)2溶液这四种物质反应发生反应,只有③和四种物质反应,故③为Na2CO3溶液;和碳酸钠③不反应的是⑥,故⑥为铁;BaCl2溶液可以和Na2CO3溶液、MgSO4溶液、稀硫酸三种物质之间发生反应,稀硫酸可以和铁、BaCl2溶液和Na2CO3溶液反应,图示中②④可以和三种物质反应,但④和铁⑥发生反应,故④为稀硫酸,②为BaCl2溶液;⑤和碳酸钠③及铁⑥,⑤为Cu(NO3)2溶液;①和②BaCl2溶液反应,故①为MgSO4溶液.
(1)图中③和⑥表示的物质分别是Na2CO3溶液和铁,故答案为:Na2CO3溶液和铁;
(2)①和②反应的离子方程式为:Ba2++SO42-=BaSO4↓,③和④反应的离子方程式为:CO32-+2H+=H2O+CO2↑,故答案为:Ba2++SO42-=BaSO4↓;CO32-+2H+=H2O+CO2↑.
点评 本题考查了物质转化关系的反应特征,物质性质的综合应用,关键是物质间相互反应的种类判断,转化图的分析应用,题目较难.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
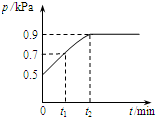 在1.0L密闭容器中放入0.1mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在1.0L密闭容器中放入0.1mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )| A. | t1时n(X)=0.04 mol | |
| B. | t1到t2,混合气体的平均相对分子量增大 | |
| C. | 欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气,NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气,NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N3-:1s22s22p3 | B. | F-:1s22s22p6 | ||
| C. | Fe2+:1s22s22p63s23p63d6 | D. | O2-:1s22s22p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为SiO2是H2SiO3的酸酐,故SiO2溶于水得H2SiO3 | |
| B. | CO2通入水玻璃(Na2SiO3的水溶液)中可以得到硅酸沉淀 | |
| C. | 因为高温时发生反应:Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强 | |
| D. | SiO2是酸性氧化物,它不溶于任何酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com