
【题目】下列变化需要吸收能量的是( )
A. 1s22s22p63s1→1s22s22p6 B. 3s23p5→3s23p6
C. 2p![]() 2p
2p![]() 2p
2p![]() →2p
→2p![]() 2p
2p![]() 2p
2p![]() D. 2H→H—H
D. 2H→H—H
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】25℃时,在0.1mol/L的草酸(H2C2O4)溶液中加入等浓度的NaOH溶液,H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的变化如图所示。下列说法不正确的是

A. 反应过程中c(H2C2O4)+c(HC2O4-)+c(C2O42-)<0.1mol/L
B. lg[K1(H2C2O4)]=-1.2
C. NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
D. 当NaOH溶液与H2C2O4溶液体积之比为3:2时,2c(Na+)+c(OH-)=2c(H2C2O4)+c(HC2O4-)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大阳能路灯蓄电池是磷酸铁锂电池,其工作原理如图。M电极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-x FePO4![]() LiFePO4+6C。下列说法正确的是
LiFePO4+6C。下列说法正确的是

A. 放电时Li+从左边移向右边,PO43-从右边移向左边
B. 放电时,正极反应式为:Li1-xFePO4+xLi++xe-= LiFePO4
C. 充电时M极连接电源的负极,电极反应为6C+xe-=C6x-
D. 充电时电路中通过2.0mol电子,产生7.0gLi
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.48 g铁铜合金完全溶解于80 mL 4.0 mol·L-1稀硝酸中,得到标准状况下672 mL NO气体(假设此时无其他气体产生),下列说法正确的是
A. 取反应后溶液,滴入几滴KSCN溶液,无血红色出现
B. 该合金中铁与铜的物质的量之比是1∶2
C. 反应后溶液(忽略溶液体积变化)中c(H+)=2.5 mol·L-1
D. 向反应后的溶液中加入2.0 mol·L-1NaOH溶液至金属离子恰好全部沉淀时,需加入NaOH溶液的体积是120 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下列路线合成新抗凝(抗血栓药物)
新抗凝

已知:I:
II:
III:![]()
(1) 所需的试剂是__________。
所需的试剂是__________。
(2) B→C分两步进行,反应类型分别是 __________、__________。
(3)下列说法不正确的是_________。
a.化合物B能使Br2/CCl4褪色
b. 化合物C能发生银镜反应
c.F遇FeCl3溶液显色
d. 新抗凝的分子式C19H15NO6
(4)E+H→新抗凝的化学方程式是_______________________。
(5)已知:![]() ,写出有关化合物的结构简式I ________F________G________。
,写出有关化合物的结构简式I ________F________G________。
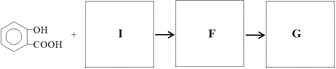
(6)写出一种符合下列条件的A的同分异构体的结构简式_____________________。
① 红外光谱表明分子中含有-COO-、苯环结构
② 1H-NMR谱显示苯环上有三种不同环境的H原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种电催化合成氨的装置如图所示。该装置工作时,下列说法正确的是

A. 图中涉及的能量转化方式共有3种
B. 两极产生的气体的物质的量之比是1:1
C. 电路中每通过1mol电子,有1mol H+迁移至a极
D. b极上发生的主要反应为N2+6H++6e-=2NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铬(CrN)是一种良好的耐磨材料,实验室可用无水氯化铬(CrCl3)与氨气在高温下反应制备,反应原理为CrCl3+NH3![]() CrN+3HCl.回答下列问题:
CrN+3HCl.回答下列问题:
(1)制备无水氯化铬。氯化铬有很强的吸水性,通常以氯化铬晶体(CrCl3·6H2O)的形式存在。直接加热脱水往往得到Cr2O3,有关反应的化学方程式为______________,以氯化铬晶体制备无水氯化铬的方法是_____________________________。
(2)制备氮化铬。某实验小组设计制备氮化铬的装置如下图所示(夹持与加热装置省略):

①装置A中发生反应的化学方程式为_____________________。
②实验开始时,要先打开装置A中活塞,后加热装置C,目的是___________________。
③装置B中盛放的试剂是____________,装置D的作用是_____________________。
④有同学认为该装置有一个缺陷,该缺陷是_______________________。
(3)氯化铬的纯度测定。制得的CrN中含有Cr2N杂质,取样品14.38g在空气中充分加热,得固体残渣(Cr2O3)的质量为16.72g,则样品中CrN的质量分数为_____________(结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为______mol·L-1。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=____mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是________(填字母)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器

B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0 g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2 000 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为______mol·L-1。
②需用浓硫酸的体积为________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在_____________________范围内。
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为_____________________________________________________________。
(3)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为_________________________________。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为_________。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:2Fe3++2I-=2Fe2++I2 2S2O32-+I2=2I-+S4O62-
则溶液中铁元素的总含量为_________g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会_______ (填“偏高” “偏低” “不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com