
【题目】Ⅰ.下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积KW | 1×10-14 | 1×10-13 | 1×10-12 |
试回答以下问题:
(1)在t2℃下,将amol·L-1CH3COOH溶液与bmol·L-1NaOH客液等体积混合反应后,溶液恰好呈中性,则该温度下CH3COOH 的电离常数Ka=_______(用a、b 表示)。
(2)25℃时,有pH=4的醋酸溶液和氯化氨溶液,醋酸中水电离高出的H+浓度与氯化氨溶液中水电离出的H+浓度之比是_______。
(3)25℃时,向体积为VamLpH=3的醋酸溶液中滴加pH=11的NaOH溶液VbmL 至溶液恰好呈中性,则Va与的Vb关系是Va_______Vb (填“>”、“<”或“=”)。
(4)醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,下列叙述不确的是(______)
CH3COO-+H+,下列叙述不确的是(______)
a.CH3COOH 溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
b.0.1mol/L的CH3COOH 溶液加水稀释,溶液中c(OH-)减小
c.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
d.常温下,pH=2的CH3COOH溶液与pH=12的NaOH 溶液等体积混合后溶液的pH<7
e .室温下,向pH=3的醋酸溶液中加水稀释,溶液中![]() 不变
不变
Ⅱ.某镁盐溶液中含有杂质离子Cr3+,所含主要离子及其浓度如下表所示(H+和OH-未列出):
离子 | Mg2+ | Cr3+ | Cl- |
浓度(mol·L-1) | 0.5 | 0.01 | a |
已知25℃时,KspCr(OH)3=10-32;KspMg(OH)2=5×10-11;操作过程中溶液体积的变化忽略不计。
(5)表格中的a___________1.03(填“<”、“>”或“=”)。
(6)除去杂质Cr3+离子,可加入MgO调节溶液pH, 理论上应调节pH的范围是_______。
(7)溶液经除杂、过滤后,由滤液制取氯化镁晶体(MgCl2·6H
【答案】 ![]() 10-10∶10-4 < b )> 4≤pH<9 或4<pH<9 滤液中加盐酸(或在HCl气流中),加热浓缩,冷却结晶,过滤
10-10∶10-4 < b )> 4≤pH<9 或4<pH<9 滤液中加盐酸(或在HCl气流中),加热浓缩,冷却结晶,过滤
【解析】Ⅰ.(1)在t2℃下,将amol·L-1CH3COOH溶液与bmol·L-1NaOH客液等体积混合反应后,溶液恰好呈中性。由于醋酸钠溶液显碱性,所以醋酸过量,反应后的溶液中,c(CH3COO-)=0.5bmol/L,c(CH3COOH)=0.5(a-b)mol/L,c(H+)=1×10-6mol/L,则该温度下CH3COOH的电离常数Ka=![]() 。
。
(2)25℃时,有pH=4的醋酸溶液和氯化氨溶液,醋酸中水的电离受到了抑制,其中水电离的H+浓度等于OH-浓度,即10-10mol/L;所化铵溶液中,水的电离受到促进,水电离高出的H+浓度等于10-4mol/L。因此,醋酸中水电离高出的H+浓度与氯化氨溶液中水电离出的H+浓度之比是10-10∶10-4(即1:1000000)。
(3)pH=3的醋酸溶液中的c(H+)与pH=11的NaOH溶液中的c(OH-)相等,由于醋酸是弱酸,不能完全电离,所以醋酸的物质的量浓度远远大于氢氧化钠的物质的量浓度,若两者等体积混合,则混合后溶液一定会因为醋酸过量而使其显酸性。因此,25℃时,向体积为VamLpH=3的醋酸溶液中滴加pH=11的NaOH溶液VbmL至溶液恰好呈中性,则Va与的Vb关系是Va<Vb。
(4)醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+。a.由电荷守恒可知,CH3COOH溶液中离子浓度的关系满足c(H+)=c(OH-)+c(CH3COO-),a正确;b.0.1mol/L的CH3COOH溶液加水稀释,溶液的酸性减弱,所以溶液中c(OH-)增大,b不正确;c.CH3COOH溶液中加入少量CH3COONa固体,可使溶液中的醋酸根离子的浓度增大,所以平衡逆向移动,c正确;d.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,过量很多的醋酸使溶液呈酸性,pH<7,d正确;e.室温下,向pH=3的醋酸溶液中加水稀释,溶液中
CH3COO-+H+。a.由电荷守恒可知,CH3COOH溶液中离子浓度的关系满足c(H+)=c(OH-)+c(CH3COO-),a正确;b.0.1mol/L的CH3COOH溶液加水稀释,溶液的酸性减弱,所以溶液中c(OH-)增大,b不正确;c.CH3COOH溶液中加入少量CH3COONa固体,可使溶液中的醋酸根离子的浓度增大,所以平衡逆向移动,c正确;d.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,过量很多的醋酸使溶液呈酸性,pH<7,d正确;e.室温下,向pH=3的醋酸溶液中加水稀释,溶液中![]() ,所以其值不变,e正确。综上所述,叙述不确的是b 。
,所以其值不变,e正确。综上所述,叙述不确的是b 。
Ⅱ.(5)根据电荷守恒可得c(Cl-)+c(OH-)=2c(Mg2+)+3c(Cr3+)+c(H+),因为氯化镁、氯化铬都可水解而使溶液呈酸性,所以c(Cl-)>2c(Mg2+)+3c(Cr3+)=(2×0.5+0.01×3)mol/L=1.03mol/L,则a>1.03。
(6)由KspCr(OH)3=10-32可知,Cr3+产生沉淀时溶液中c(OH-)=![]() =
=![]() mol/L=10-10mol/L,则溶液的pH=4;由KspMg(OH)2=5×10-11可知,Mg2+产生沉淀时溶液中c(OH-)=
mol/L=10-10mol/L,则溶液的pH=4;由KspMg(OH)2=5×10-11可知,Mg2+产生沉淀时溶液中c(OH-)=![]() =
=![]() mol/L=10-5mol/L,则溶液的pH=9。调节溶液的pH时,要保证除去铬离子,但不能让镁离子转化为氢氧化镁沉淀,所以理论上应调节pH的范围是4≤pH<9或4<pH<9 。
mol/L=10-5mol/L,则溶液的pH=9。调节溶液的pH时,要保证除去铬离子,但不能让镁离子转化为氢氧化镁沉淀,所以理论上应调节pH的范围是4≤pH<9或4<pH<9 。
(7)通常从溶液中获取结晶水合物的操作是加热浓缩、冷却结晶、过滤。因为氯化镁易水解,为防止其水解,应该加入适量的盐酸,然后再加热浓缩,冷却结晶,过滤。所以,由滤液制取氯化镁晶体(MgCl2·6H2O)的操作是滤液中加盐酸(或在HCl气流中),加热浓缩,冷却结晶,过滤。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学设计如图装置:


回答下列问题:
(1)乙中铜片为________极 (填“正”或“负”),其电极反应式为________。
(2)一段时间后,将甲和乙两池溶液混合,加入H2O2和一定量稀硫酸后,有Fe(OH)3沉淀出现,但没有Cu(OH)2沉淀出现,此时溶液中c(Fe3+)=2.6×10-18 mol·L-1,求溶液中Cu2+的最大物质的量浓度________。(写出计算步骤)(已知2Fe2++H2O2+2H+=2Fe3++2H2O,Ksp[Fe(OH)3]=2.6×10-39,Ksp[Cu(OH)2]=2.2×10-20)。
(3)丙中电源的A极为________极(填“正”或“负”)。
(4)若丙池盛放足量的CuSO4溶液:
①在丙池铁棒这极的现象是________。
②在丙池中阳极的电极反应是________。
(5)若丙池中盛放滴加少量酚酞的足量的饱和NaCl溶液1L(假设溶液体积电解前后无变化)。
①丙池通电一段时间后,________极附近溶液呈红色(填Fe或C),总反应的离子方程式:________。
②25℃时,当丙池中有0.1mol电子发生转移时切断电源,则理论上标准状况下共有________ L气体生成。此时溶液的pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时向20mL0.1mol·L-1MOH 溶液中滴加0.1mol·L-1CH3COOH溶液,所得溶液的pH 及导电能力变化如图所示,下列叙述正确的是( )
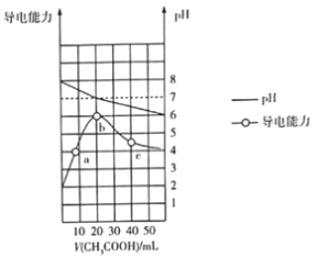
A. MOH 是强电解质
B. b点对应的盐不水解
C. c 点溶液中:c(CH3COO-)>c(M+)>c(H+)>c(OH-)
D. a 点溶液中:c(OH-)+c(CH3COO-)+)+c(M+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能一步实现的是( )
A. Fe ![]() Fe2O3
Fe2O3 ![]() FeCl3(aq)
FeCl3(aq)
B. N2 ![]() NH3
NH3 ![]() NO
NO
C. SiO2 ![]() H2SiO3
H2SiO3 ![]() Na2SiO3(aq)
Na2SiO3(aq)
D. Al2O3 ![]() Al(OH)3
Al(OH)3 ![]() AlCl3(aq)
AlCl3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是部分矿物资源的利用及产品流程(如图),有关说法不平确的是
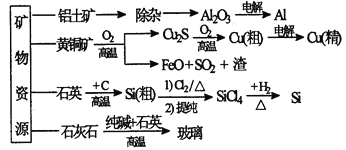
A. 粗铜电解精炼时,粗铜作阳极
B. 生产铝、铜、高纯硅及玻璃过程中都涉及氧化还原反应
C. 黄铜矿冶铜时,副产物SO2可用于生产硫酸,FeO可用作冶铁的原料
D. 粗硅制高纯硅时,提纯四氯化硅可用多次分馏的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成。已知NOCl是一种红褐色液体或黄色气体,其熔点64.5℃,沸点5.5℃,遇水易水解。
(1)实验室制备原料气NO和Cl2的装置如下图所示:

①实验室制NO时,装置A中烧瓶内发生反应的化学方程式为_______。
②实验室制Cl2时,装置B中盛放的试剂为________,其作用是________。
(2)将上述收集到的Cl2充入集气瓶中,按图示装置制备亚硝酰氯。
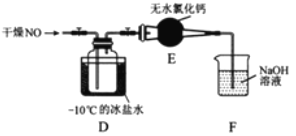
①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为________。
②装置D中的现象为________。
③装置E中无水氯化钙的作用为________。
④某同学认为装置F不能吸收NO,为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是________。
(3)NO可用间接电化学法除去,其原理如下图所示:

①阴极的电极反应式为______________________。
②吸收塔内发生反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,R和T是两种生活中常见的金属单质,C、F是无色无味的气体。
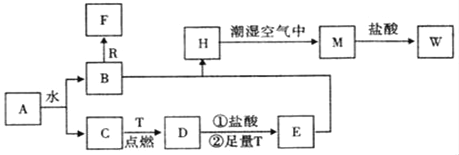
(1)物质A的化学式为_____,D化学式为_____,W的化学式为_____;
(2)B与R反应生成F的离子反应式为___________;
(3)A与CO2反应的化学反应方程式为____________;
(4)H转化为M的化学反应方程式为_____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别向盛有等物质的量浓度的稀硫酸和氢氧化钠溶液的烧杯中加入足量的铝,反应后放出的气体体积在标准状况下为1︰2,则所取稀硫酸和氢氧化钠溶液的体积比为
A. 1︰2 B. 3︰4 C. 3︰2 D. 6︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在密闭容器里SO2、O2、SO3三种气态物质建立化学平衡后,改变条件,对反应2SO2 + O2 ![]() 2SO3(正反应放热)的正、逆反应速率影响的图象如右图所示:
2SO3(正反应放热)的正、逆反应速率影响的图象如右图所示:

(1)加催化剂的图象是___________。
(2)升高温度的图象是___________。
(3)增大容器体积的图象是_______。
(4)增大O2的浓度的图象是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com