
【题目】已知A为淡黄色固体,R和T是两种生活中常见的金属单质,C、F是无色无味的气体。
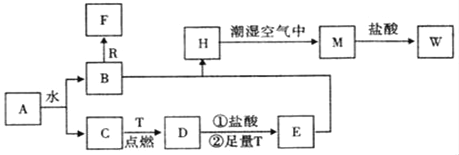
(1)物质A的化学式为_____,D化学式为_____,W的化学式为_____;
(2)B与R反应生成F的离子反应式为___________;
(3)A与CO2反应的化学反应方程式为____________;
(4)H转化为M的化学反应方程式为_____________;
【答案】Na2O2 Fe3O4 FeCl3 2Al+2OH﹣+2H2O=2AlO﹣2+3H2↑ 2Na2O2+2CO2=2Na2CO3+O2 4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】
A为淡黄色固体,能与水反应,即A为Na2O2,Na2O2与水反应:2Na2O2+2H2O=4NaOH+O2↑,C为无色无味的气体,即C为O2,B为NaOH,R为常见金属单质,即R为Al,F为无色无味气体,即F为H2,T为两种生活中常见的金属单质,即T为Fe,D为Fe3O4,E为FeCl2,H为Fe(OH)2,M为Fe(OH)3,W为FeCl3;
A为淡黄色固体,能与水反应,即A为Na2O2,Na2O2与水反应:2Na2O2+2H2O=4NaOH+O2↑,C为无色无味的气体,即C为O2,B为NaOH,R为常见金属单质,即R为Al,F为无色无味气体,即F为H2,T为两种生活中常见的金属单质,即T为Fe,D为Fe3O4,Fe3O4与盐酸反应生成FeCl2和FeCl3,加入过量的Fe,Fe与FeCl3反应生成FeCl2,即E为FeCl2,H为Fe(OH)2,M为Fe(OH)3,W为FeCl3,
(1)根据上述分析,物质A为Na2O2,D的化学式为Fe3O4,W的化学式为FeCl3;
(2)Al与NaOH溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)Na2O2与CO2反应的方程式为2Na2O2+2CO2=2Na2CO3+O2;
(4)Fe(OH)2被氧气氧化成Fe(OH)3,其反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。


科目:高中化学 来源: 题型:
【题目】下列事实与平衡移动原理无关的是
A. 向含酚酞的Na2CO3溶液中滴加BaCl2溶液,红色变浅
B. 加热MgCl2·6H2O固体最终得到Mg(OH)Cl
C. 将FeS2矿石粉碎更有利于焙烧制备SO2气体
D. NO2气体经过冷凝和加压成无色液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
氯贝特( )是临床上一种抗血栓药物.它的一种合成路线如下(图中部分反应条件及部分反应物、生成物已略去)。
)是临床上一种抗血栓药物.它的一种合成路线如下(图中部分反应条件及部分反应物、生成物已略去)。

回答下列问题:
(1)有机物F的分子式为______________,其核磁共振氢谱有______________个峰,该物质中含有的官能团名称为_____________________。
(2)C的结构简式为_________,要实现反应I的转化,加入下列物质能达到目的是________。
a.Na b.NaHCO3 c.NaOH d. Na2CO3
(3)写出反应Ⅲ的化学方程式____________________________________________________,反应Ⅲ的反应类型为_______________________。
(4)产物E有多种同分异构体,满足下列条件的所有同分异构体Y有______________种。
① 属于酯类且与FeCl3溶液显紫色 ② 能发生银镜反应
③苯环上只有2个取代基且处于对位 ④ 1molY最多与2molNaOH反应
(5)结合以上合成路线信息,设计以CH3CH2COOH为原料(无机试剂任选),合成有机物![]() 的合成路线____________________________________________________。
的合成路线____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积KW | 1×10-14 | 1×10-13 | 1×10-12 |
试回答以下问题:
(1)在t2℃下,将amol·L-1CH3COOH溶液与bmol·L-1NaOH客液等体积混合反应后,溶液恰好呈中性,则该温度下CH3COOH 的电离常数Ka=_______(用a、b 表示)。
(2)25℃时,有pH=4的醋酸溶液和氯化氨溶液,醋酸中水电离高出的H+浓度与氯化氨溶液中水电离出的H+浓度之比是_______。
(3)25℃时,向体积为VamLpH=3的醋酸溶液中滴加pH=11的NaOH溶液VbmL 至溶液恰好呈中性,则Va与的Vb关系是Va_______Vb (填“>”、“<”或“=”)。
(4)醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,下列叙述不确的是(______)
CH3COO-+H+,下列叙述不确的是(______)
a.CH3COOH 溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
b.0.1mol/L的CH3COOH 溶液加水稀释,溶液中c(OH-)减小
c.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
d.常温下,pH=2的CH3COOH溶液与pH=12的NaOH 溶液等体积混合后溶液的pH<7
e .室温下,向pH=3的醋酸溶液中加水稀释,溶液中![]() 不变
不变
Ⅱ.某镁盐溶液中含有杂质离子Cr3+,所含主要离子及其浓度如下表所示(H+和OH-未列出):
离子 | Mg2+ | Cr3+ | Cl- |
浓度(mol·L-1) | 0.5 | 0.01 | a |
已知25℃时,KspCr(OH)3=10-32;KspMg(OH)2=5×10-11;操作过程中溶液体积的变化忽略不计。
(5)表格中的a___________1.03(填“<”、“>”或“=”)。
(6)除去杂质Cr3+离子,可加入MgO调节溶液pH, 理论上应调节pH的范围是_______。
(7)溶液经除杂、过滤后,由滤液制取氯化镁晶体(MgCl2·6H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实对应的离子方程式或电极反应式书写正确的是( )
A. 用石墨作电极电解CuSO4溶液2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
B. 碳酸钠溶液显碱性:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
C. 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+
D. 在强碱溶液中Fe(OH)3与NaClO反应生成Na2FeO4:3ClO-+2 Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置(夹持仪器省略)进行实验,将液体A逐渐加入固体B中。回答下列问题:
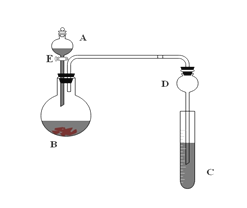
(1)图中D装置在实验中的作用____________________;
(2)若A中为浓盐酸,B中为高锰酸钾,C中盛有KI淀粉溶液,旋开E后,C中的现象是溶液变蓝色,试写出A与B反应的化学方程式_________________________:
(3)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E足够长的时间后,C中的现象是____________________,C中发生反应的化学方程式为:__________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种医药中间体,可通过下图所示路线合成,A是石油化工的重要产品且分子中所有原子在同一平面上,H的分子式是C7H8。
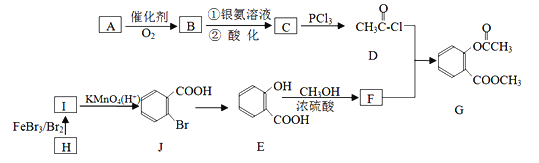
已知: B为醛类,C为一种常见的酸。
请回答以下问题:
(1)A的结构简式是__________。
(2)H→I的反应方程式_______________________,E→F的化学方程式是____________________。
(3)C→D的反应类型是_____________,I→J的反应类型是________________。
(4)两个E分子在一定条件下发生分子间脱水生成一种环状酯的结构简式是_____________。
(5)H的同系物中分子式为C9H12的同分异构体共有__________(填数字)种。其中核磁共振氢谱峰面积之比为6∶3∶2∶1的物质的结构简式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上CO2用于生产燃料甲醇,既能缓解温室效应,也为能源寻找了新渠道。合成甲醇的反应为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。
(1)已知:CO的燃烧热△H=-283.0kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
CO(g)+2H2(g) ![]() CH3OH(g) △H=-90.1KJ/mol
CH3OH(g) △H=-90.1KJ/mol
则:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=___KJ/mol
CH3OH(g)+H2O(g) △H=___KJ/mol
(2)T℃时,测得不同时刻恒容密闭容器中CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度变化如下表所示
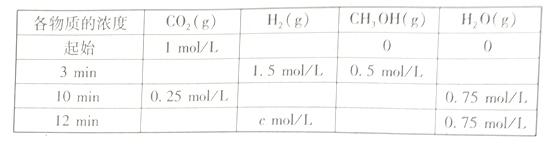
①c=___mol/L,从反应开始到平衡时,CH3OH的平均反应速率v(CH3OH)=__
②下列能说明该反应达到平衡状态的是____________
A.每消耗 1mol CO2的同时生成1 mol CH3OH
B.容器中气体的压强不再改变
C.混合气体的平均相对分子质量不发生变化
D.容器中气体的密度不再改变
(3)在催化剂作用下,若测得甲醇的产率与反应温度、压强的关系如下图所示:
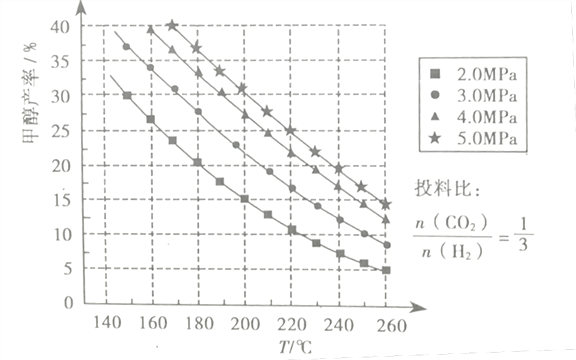
①分析图中数据可知,在220℃、5.0MPa时,CO2的转化率为__将温度降低至140℃、压强减小至2.0MPa,CO2的转化率将___(填“增大”、“减小”或“不变”)
②200℃、2.0MPa时,将amol/LCO2和3amol/LH2充入VL密闭容器中,在催化剂作用下反应达到平衡。根据图中数据计算所得甲醇的质量为___g(用含a的代数式表示)
(4)用NaOH溶液吸收CO2所得饱和碳酸钠溶液可以对废旧电池中的铅膏(主要成分PbSO4)进行脱硫反应。已知Ksp(PbSO4)=1.6x10-8,Ksp(PbCO3)=7.4×10-14,
PbSO4(s)+CO32-(aq) ![]() PbCO3(s)+SO42-(aq),则该反应的平衡常数K=______(保留三位有效数字);若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将______(填“增大”、“减小、”或“不变”)。
PbCO3(s)+SO42-(aq),则该反应的平衡常数K=______(保留三位有效数字);若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将______(填“增大”、“减小、”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com