
ЎҫМвДҝЎҝ»ҜәПОпXКЗТ»ЦЦУР»ъәПіЙЦРјдМеЈ¬ZКЗіЈјыөДёЯ·ЦЧУ»ҜәПОпЈ¬ДіСРҫҝРЎЧйІЙУГИзПВВ·ПЯәПіЙXәНZЈә
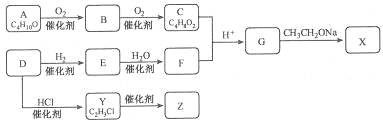
ТСЦӘЈәўЩ»ҜәПОпAөДҪб№№ЦРУР2ёцјЧ»щ
ўЪRCOORЎд+RЎдЎдCH2COORЎд![]()
![]()
Зл»ШҙрЈә
ЈЁ1Ј©Рҙіц»ҜәПОпEөДҪб№№јтКҪ__________Ј¬FЦР№ЩДЬНЕөДГыіЖКЗ_________ЎЈ
ЈЁ2Ј©YЎъZөД»ҜС§·ҪіМКҪКЗ____________ЎЈ
ЈЁ3Ј©GЎъXөД»ҜС§·ҪіМКҪКЗ__________Ј¬·ҙУҰАаРНКЗ___________ЎЈ
ЈЁ4Ј©ИфCЦР»мУРBЈ¬ЗлУГ»ҜС§·Ҫ·ЁјмСйBөДҙжФЪЈЁТӘЗуРҙіцІЩЧчЎўПЦПуәНҪбВЫЈ©_________ЎЈ
Ўҫҙр°ёЎҝЈЁ1Ј©CH2=CH2фЗ»щ
ЈЁ2Ј©![]()
ЈЁ3Ј©
ИЎҙъ·ҙУҰ
ЈЁ4Ј©ИЎККБҝКФСщУЪКФ№ЬЦРЈ¬ПИУГNaOHЦРәНЈ¬ФЩјУИлРВЦЖЗвСх»ҜНӯРьЧЗТәЈ¬јУИИЈ¬ИфІъЙъЧ©әмЙ«іБөнФтУРBҙжФЪЎЈ
ЎҫҪвОцЎҝКФМв·ЦОцЈә»ҜәПОпAДЬ·ўЙъБ¬РшСх»ҜТАҙОЙъіЙBЎўCЈ¬ФтAОӘұҘәНТ»ФӘҙјЈ¬AөДҪб№№ЦРУР2ёцјЧ»щЈ¬ФтAОӘ(CH3)2CHCH2OH, BОӘ(CH3)2CHCHOЈ¬CОӘ(CH3)2CHCOOHЈ¬CУлFФЪЛбРФ»·ҫіПВЙъіЙGЈ¬ФтGОӘхҘЈ¬FОӘҙјЈ¬ёщҫЭYөДә¬МјКэҝЙЦӘЈ¬DОӘТТИІЈ¬EОӘТТП©Ј¬FОӘТТҙјЎЈ
ЈЁ1Ј©ёщҫЭЙПКц·ЦОцЈ¬EОӘТТП©Ј¬Ҫб№№јтКҪОӘCH2=CH2Ј¬FОӘТТҙјЈ¬ә¬УРөД№ЩДЬНЕОӘфЗ»щЎЈ
ЈЁ2Ј©ZКЗіЈјыөДёЯ·ЦЧУ»ҜәПОпЈ¬YЎъZКЗВИТТП©өДјУҫЫ·ҙУҰЈ¬ЛщТФ·ҙУҰөД»ҜС§·ҪіМКҪКЗЈә
![]() ЎЈ
ЎЈ
ЈЁ3Ј©ёщҫЭТСЦӘўЪЈ¬GЎъXөД»ҜС§·ҪіМКҪКЗЈә![]() Ј»ёщҫЭ·ҙУҰМШөгЈ¬ёГ·ҙУҰөД·ҙУҰАаРНКЗИЎҙъ·ҙУҰЎЈ
Ј»ёщҫЭ·ҙУҰМШөгЈ¬ёГ·ҙУҰөД·ҙУҰАаРНКЗИЎҙъ·ҙУҰЎЈ
ЈЁ4Ј©CОӘ(CH3)2CHCOOHЈ¬BОӘ(CH3)2CHCHOЈ¬CЦРә¬УРBЈ¬Ц»РиТӘјмСйИ©»щКЗ·сҙжФЪјҙҝЙЈ¬јҙИЎККБҝКФСщУЪКФ№ЬЦРЈ¬ПИУГNaOHЦРәНЈ¬ФЩјУИлРВЦЖЗвСх»ҜНӯРьЧЗТәЈ¬јУИИЈ¬ИфІъЙъЧ©әмЙ«іБөнЈ¬ФтУРBҙжФЪЎЈ



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
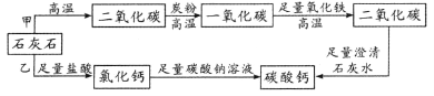
ЎҫМвДҝЎҝПВБР·ҙУҰЈә
ўЩЗвСх»ҜДЖУлБтЛбЈ¬ўЪТ»Сх»ҜМјУлСхЖшЈ¬ўЫ°ЛЛ®әПЗвСх»ҜұөУлВИ»Ҝп§Ј¬ўЬҪрКфНӯУлПхЛбТшЎЈ
ЈЁ1Ј©КфУЪёҙ·ЦҪв·ҙУҰөД·ЕИИ·ҙУҰөДКЗ____________________________ЎЈ(УГРтәЕМоҝХ)
ЈЁ2Ј©КфУЪОьИИ·ҙУҰөДКЗ_____________________________________________ЎЈ(УГРтәЕМоҝХ)
ЈЁ3Ј©ДЬЙијЖіЙФӯөзіШөД·ҙУҰКЗ_______________________________________ЎЈ(УГРтәЕМоҝХ)
ЈЁ4Ј©ДЬЙијЖіЙИјБПөзіШөД·ҙУҰКЗ_____________________________________ЎЈ(УГРтәЕМоҝХ)
ЈЁ5Ј© РҙіцўЫ·ўЙъ·ҙУҰөД»ҜС§·ҪіМКҪ___________________________________ЎЈ
РҙіцўЬ·ўЙъ·ҙУҰөДАлЧУ·ҪіМКҪ___________________________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРУР№ШУНЦ¬өДРрКцІ»ХэИ·өДКЗЈЁ Ј©
AЈ®УНЦ¬КфУЪхҘАа
BЈ®УНЦ¬Г»УР№М¶ЁөДИЫ·Рөг
CЈ®УНЦ¬КЗёЯј¶Ц¬·ҫЛбөДёКУНхҘ
DЈ®УНЦ¬¶јІ»ДЬК№деЛ®НКЙ«
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝҪрКфЈЁMЈ©ЁCҝХЖшөзіШЈЁИзНјЈ©ҫЯУРФӯБПТЧөГЎўДЬБҝГЬ¶ИёЯөИУЕөгЈ¬УРНыіЙОӘРВДЬФҙЖыіөәНТЖ¶ҜЙиұёөДөзФҙЎЈёГАаөзіШ·ЕөзөДЧЬ·ҙУҰ·ҪіМКҪОӘЈә4M+nO2+2nH2O=4M(OH) nЎЈТСЦӘЈәөзіШөДЎ°АнВЫұИДЬБҝЎұЦёөҘО»ЦКБҝөДөзј«ІДБПАнВЫЙПДЬКН·ЕіцөДЧоҙуөзДЬЎЈПВБРЛө·ЁІ»ХэИ·өДКЗ

A. ІЙУГ¶аҝЧөзј«өДДҝөДКЗМбёЯөзј«УлөзҪвЦКИЬТәөДҪУҙҘГж»эЈ¬ІўУРАыУЪСхЖшА©ЙўЦБөзј«ұнГж
B. ұИҪПMgЎўAlЎўZnИэЦЦҪрКфЁCҝХЖшөзіШЈ¬AlЁCҝХЖшөзіШөДАнВЫұИДЬБҝЧоёЯ
C. MЁCҝХЖшөзіШ·Еөз№эіМөДХэј«·ҙУҰКҪЈә4Mn++nO2+2nH2O+4neЁC=4M(OH)n
D. ФЪMgЁCҝХЖшөзіШЦРЈ¬ОӘ·АЦ№ёәј«ЗшіБ»эMg(OH)2Ј¬ТЛІЙУГЦРРФөзҪвЦКј°СфАлЧУҪ»»»ДӨ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРФӯЧУөДјЫөзЧУ№№РНЦРЈ¬өЪТ»өзАлДЬЧоРЎөДКЗЈЁ Ј©
A. 2s22p4 B. 3s23p4 C. 4s24p4 D. 5s25p4
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТСЦӘCoClnЎӨmNH3ҝЙұнКҫЈ«3јЫCoөДТ»ЦЦ°ЛГжМеЕдәПОпЈ¬Иф0.1 molЕдәПОпУлЧгБҝAgNO3ЧчУГЙъіЙ0.2 mol AgClіБөнЈ¬ФтmЎўnөДЦөКЗЈЁ Ј©
AЈ®mЈҪ4Ј¬nЈҪ2
BЈ®mЈҪ4Ј¬nЈҪ5
CЈ®mЈҪ3Ј¬nЈҪ3
DЈ®mЈҪ5Ј¬nЈҪ3
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝУЙјёЦЦАлЧУ»ҜәПОпЧйіЙөД»мәПОпЈ¬ә¬УРТФПВАлЧУЦРөДИфёЙЦЦЈәK+ЎўNH4+ЎўMg2+ЎўCu2+ЎўBa2+ЎўC1ЎӘЎўSO42ЎӘЎўCO32-ЎЈҪ«ёГ»мәПОпИЬУЪЛ®әуөГОЮЙ«іОЗеИЬТәЈ¬ПЦ·ЦұрИЎ3·Э100mLёГИЬТәҪшРРИзПВКөСйЈә
КөСйРтәЕ | КөСйДЪИЭ | КөСйҪб№ы |
a | јУAgNO3ИЬТә | УР°ЧЙ«іБөнЙъіЙ |
b | јУЧгБҝNaOHИЬТәІўјУИИ | КХјҜөҪЖшМе1Ј®12LЈЁТСХЫЛгіЙұкЧјЧҙҝцПВөДМе»эЈ© |
c | јУЧгБҝBaC12ИЬТәКұЈ¬¶ФЛщөГіБөнҪшРРПҙөУЎўёЙФпЎўіЖБҝЈ»ФЩПтіБөнЦРјУЧгБҝПЎСОЛбЈ¬И»әуёЙФпЎўіЖБҝ | өЪТ»ҙОіЖБҝ¶БКэОӘ6Ј®27gЈ¬өЪ¶юҙОіЖБҝ¶БКэОӘ2Ј®33g |
КФ»ШҙрПВБРОКМвЈә
ЈЁ1Ј©ёГ»мәПОпЦРТ»¶ЁІ»ҙжФЪөДАлЧУКЗ ЎЈ
ЈЁ2Ј©КФРҙіцКөСйb·ўЙъ·ҙУҰөДАлЧУ·ҪіМКҪ ЎЈ
ЈЁ3Ј©ИЬТәЦРТ»¶ЁҙжФЪөДТхАлЧУј°ЖдОпЦКөДБҝЕЁ¶ИЈЁҝЙІ»МоВъЈ©Јә
ТхАлЧУ·ыәЕ | ОпЦКөДБҝЕЁ¶ИЈЁmolЎӨLЎӘ1Ј© |
ЈЁ4Ј©ЕР¶П»мәПОпЦРКЗ·сҙжФЪK+Ј¬Из№ыІ»ҙжФЪЈ¬ЗлЛөГчАнУЙЈ¬Из№ыҙжФЪЈ¬ЗлЗуіцCЈЁK+Ј©өДИЎЦө·¶О§Јҝ ЎЈ
ЈЁ5Ј©Ba2Ј«КЗТ»ЦЦЦШҪрКфАлЧУЈ¬Ді»·ҫіјаІвРЎЧйУыАыУГNa2S2O3ЎўKIЎўK2Cr2O7өИКФјБІв¶ЁДі№Өі§·ПЛ®ЦРBa2+өДЕЁ¶ИЎЈИЎ·ПЛ®50Ј®00mLЈ¬ҝШЦЖККөұөДЛб¶ИјУИлЧгБҝөДK2Cr2O7ИЬТәЈ¬өГBaCrO4іБөнЈ»іБөнҫӯПҙөУЎў№эВЛәуЈ¬УГККБҝөДПЎСОЛбИЬҪвЈ¬ҙЛКұCrO42ЈӯИ«ІҝЧӘ»ҜОӘCr2O72ЈӯЈ»ФЩјУ№эБҝKIИЬТә·ҙУҰЈ¬·ҙУҰТәЦРФЩөОјУ0Ј®100 molЎӨLЈӯ1Na2S2O3ИЬТәЈ¬·ҙУҰНкИ«КұЈ¬ПыәДNa2S2O3ИЬТә36Ј®00mLЎЈТСЦӘУР№ШөДАлЧУ·ҪіМКҪОӘЈә
ўЩCr2O72ЈӯЈ«6IЈӯЈ«14HЈ«ЈҪ2Cr3Ј«Ј«3I2Ј«7H2O/span>Ј»
ўЪI2Ј«2S2O32ЈӯЈҪ2IЈӯЈ«S4O62ЈӯЎЈ
КФјЖЛгёГ№Өі§·ПЛ®ЦРBa2Ј«өДОпЦКөДБҝЕЁ¶ИЎЈЈЁРҙіцҫЯМејЖЛг№эіМЈ©
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝУЕЦКМјЛбёЖКЗЦЖФмСАёаөДФӯБПЦ®Т»,ДіН¬С§АыУГөИЦКБҝН¬ЦЦКҜ»ТКҜЦЖУЕЦКМјЛбёЖЎЈЙијЖИзНјЛщКҫөДјЧЎўТТБҪМхВ·ПЯЈЁјЩЙиФУЦКІ»ІОУл·ҙУҰЈ¬ГҝТ»ІҪ·ҙУҰНкИ«Ј©ЎЈПВБРЖАјЫХэИ·өДКЗ
AЈ®јЧЎўТТ·Ҫ°ёЦЖөГМјЛбёЖЦКБҝПаөИЈ¬јЧ·Ҫ°ё·ҙУҰМхјюҝБҝМЎў№эіМёҙФУ
BЈ®јЧЎўТТБҪ·Ҫ°ёЦЖөГМјЛбёЖЦКБҝПаөИЈ¬ТТ·Ҫ°ёІЩЧчјтөҘЎў°ІИ«ҝЙҝҝ
CЈ®јЧ·Ҫ°ёЦЖөГМјЛбёЖКЗТТ·Ҫ°ёөД2ұ¶Ј¬ОВ¶ИёЯЎў·ҙУҰЛЩВКҝмЈ¬ұИТТ·Ҫ°ёәГ
DЈ®јЧ·Ҫ°ёЦЖөГМјЛбёЖКЗТТ·Ҫ°ёөД2ұ¶,ө«ТТөДІЩЧчјтөҘЈ¬·ҙУҰ»·ҪЪЙЩ,ЧЫәПЖрАҙұИјЧ·Ҫ°ёәГ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
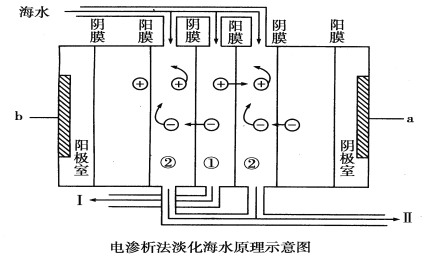
ЎҫМвДҝЎҝ ЧФИ»»·ҫіМṩөДДЬ№»ОӘИЛАаАыУГөДөӯЛ®ЧКФҙІўІ»·бё»Ј¬¶шЗТөӯЛ®ЧКФҙИұ·ҰөДРОКЖИХТжСПҫюЎЈөШЗтөДәЈЛ®ЧЬБҝФјОӘ1.3ЎБ109ТЪ¶ЦЈ¬КЗИЛАаЧоҙуөДЛ®ЧКФҙҝвЎЈөзЙшОц·ЁКЗҪьДк·ўХ№ЖрАҙөДТ»ЦЦҪПәГөДәЈЛ®өӯ»ҜјјКхЈ¬ЖдФӯАнИзПВНјЛщКҫЈә
»ШҙрПВБРОКМвЈә
ЈЁ1Ј©ҙуәЈЦРөДәЈЛ®________(МоЎ°ДЬЎұ»тЎ°І»ДЬЎұ)ЦұҪУНЁИлөҪЧ°ЦГЦРЈ¬АнУЙКЗ_______________________ЎЈ
ЈЁ2Ј©aКЗөзФҙөД________ј«Ј¬bКЗөзФҙөД________ј«ЎЈ
ЈЁ3Ј©ўЩКЗ________КТ(МоЎ°өӯЛ®Ўұ»тЎ°ЕЁЛ®Ўұ)Ј¬ўтҝЪЕЕіцөДКЗ________(МоЎ°өӯЛ®Ўұ»тЎ°ЕЁЛ®Ўұ)ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com