
【题目】 自然环境提供的能够为人类利用的淡水资源并不丰富,而且淡水资源缺乏的形势日益严峻。地球的海水总量约为1.3×109亿吨,是人类最大的水资源库。电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示:
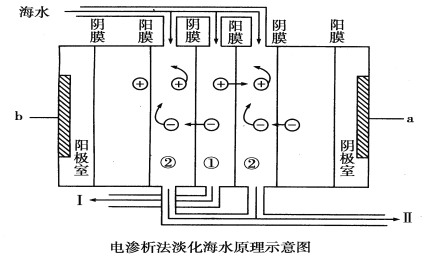
回答下列问题:
(1)大海中的海水________(填“能”或“不能”)直接通入到装置中,理由是_______________________。
(2)a是电源的________极,b是电源的________极。
(3)①是________室(填“淡水”或“浓水”),Ⅱ口排出的是________(填“淡水”或“浓水”)。
【答案】
(1)不能;海水中往往有一些悬浮杂质,需要把海水经过沉降、过滤后才能通入该装置中
(2)负;正 ;
(3)淡水;浓水
【解析】
试题分析:(1)海水中往往有一些悬浮杂质,需要把海水经过沉降、过滤后才能通入该装置中,另外海水中含有海水中含较多Mg2+和Ca2+等阳离子,电解时阴极附近生成氢氧根离子,导致氢氧根离子和钙镁离子反应生成Mg(OH)2、Ca(OH)2等沉淀从而堵塞阳离子交换膜,从而抑制离子通过,导致电渗析法失败,故答案为:不能;海水中往往有一些悬浮杂质,需要把海水经过沉降、过滤后才能通入该装置中;
(2)分析装置图,a为负极,b为电源正极, 故答案为:负;正;
(3)在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,①室离子浓度变小,②室离子浓度变大,离子浓度大的为浓水,所以浓水在Ⅱ处排出,Ⅰ处排出的是淡水,故答案为:淡水;浓水。


科目:高中化学 来源: 题型:
【题目】化合物X是一种有机合成中间体,Z是常见的高分子化合物,某研究小组采用如下路线合成X和Z:
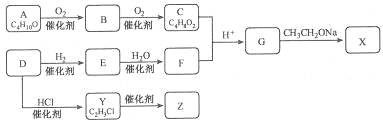
已知:①化合物A的结构中有2个甲基
②RCOOR′+R′′CH2COOR′![]()
![]()
请回答:
(1)写出化合物E的结构简式__________,F中官能团的名称是_________。
(2)Y→Z的化学方程式是____________。
(3)G→X的化学方程式是__________,反应类型是___________。
(4)若C中混有B,请用化学方法检验B的存在(要求写出操作、现象和结论)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达平衡,平衡常数K=![]() 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A、该反应的焓变为正值
B、恒温恒容下,增大压强,H2浓度一定减小
C、升高温度,逆反应速率减小
D、该反应化学方程式为CO+H2O=CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异戊二烯是重要的有机化工原料,其结构简式为CH2=C(CH3)CH=CH2。
完成下列填空:
(1)化合物X与异戊二烯具有相同的分子式,与Br2/CCl4反应后得到3-甲基-1,1,2,2-四溴丁烷。X的结构简式为_______________。
(2)异戊二烯的一种制备方法如下图所示:
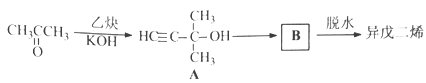
A能发生的反应有___________。(填反应类型)
B的结构简式为______________。
(3)设计一条由异戊二烯制得有机合成中间体 的合成路线。
的合成路线。
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是重要的化工原料,也是应用广泛的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。
完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00mol NH4HCO3完全分解,分解产物经干燥后的体积为_________L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
(3)CO2和KO2有下列反应:
4KO2+2CO2→2K2CO3+3O2
4KO2+4CO2+2H2O→4KHCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 molO2,则反应前密封舱内H2O的量应该是多少?列式计算。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O![]() CO+3H2
CO+3H2
已知:CO+2H2![]() CH3OH CO2+3H2
CH3OH CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为氮及其化合物的类别与化合价对应的关系图。

(1)实验室制取氨气。
① 化学方程式是 。
② 可用向下排空气法收集氨气的原因是 。
③ 用水吸收多余的氨气时,如将导管直接插入水中,会产生倒吸现象,产生该现象的原因是 。
(2)完成下列能生成NO的化学方程式:
① 体现N元素的还原性:_________。
a.汽车尾气中产生的NO:N2 + O2 ![]() 2NO。
2NO。
b.氨的催化氧化:_________。
② 体现N元素的氧化性:_________。
(3)NO2 易溶于水。将体积为V mL的试管充满NO2后倒扣在水中,见右图。
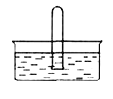
① NO2溶于水的化学方程式是_________。
② 使试管中NO2完全被水吸收的操作是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。磷尾矿主要含Ca5(PO4)3F和CaCO3·MgCO3。某研究小组提出了磷尾矿综合利用的研究方案,制备具有重要工业用途的CaCO3、Mg(OH)2、P4和H2,其简化流程如下:

已知:①Ca5(PO4)3F在950℃不分解;
②4Ca5(PO4)3F+18SiO2+30C![]() 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4
请回答下列问题:
(1)950℃煅烧磷尾矿生成气体的主要成分是___________。
(2)实验室过滤所需的玻璃仪器是_____________。
(3)NH4NO3溶液能从磷矿Ⅰ中浸取出Ca2+的原因是__________。
(4)在浸取液Ⅱ中通入NH3,发生反应的化学方程式是____________。
(5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ΔH=-271kJ/mol
5 CaO(s)+3H3PO4(l)+HF(g)= Ca5(PO4)3F (s)+5H2O(l) ΔH=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是_________________。
(6)在一定条件下CO(g)+H2O(g)![]() CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了
CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了![]() 。若a kg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2________kg。
。若a kg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
(1)第四周期过渡元素的明显特征是形成多种多样的配合物
① CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5].羰基镍[Ni(CO)4]。CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为 ,与CO互为等电子体的离子为 (填化学式)。
② 金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测Ni(CO)4易溶于下列 。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。镓的基态原子的电子排布式是 ,Ga的第一电离能却明显低于Zn,原因是 。
(3)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是 。
A.直线形;三角锥形
B.V形;三角锥形
C.直线形;平面三角形
D.V形;平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性KMnO4溶液可氧化C2H4生成CO2气体。则下列可用来鉴别CH4和C2H4,又可除去CH4中混有C2H4的方法是( )
A. 通入H2后加热
B. 通入酸性KMnO4溶液中
C. 通入足量的溴水中
D. 点燃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com